Загальні властивості металів
Переважній більшості елементів Періодичної системи (понад 80%) у вільному стані відповідають прості речовини метали. До елементів, які існують у вигляді простих речовин-металів, належать s-елементи І і II груп (окрім Гідрогену), усі d- і f-елементи, а також р-елементи головних підгруп: ІІІ (крім В), ІV (Ge, Sn, Pb), V (Sb, Bi) і VI ( Po) груп. Деяким елементам (Германій, Стибій, Силіцій) відповідають прості речовини, що поєднують металічні властивості з неметалічними.
Атоми металів, як правило, мають у зовнішньому електронному шарі 1,2 і значно рідше 3 або 4 електрони та великі атомні радіуси.
Метали визначаються здатністю їхніх атомів легко віддавати свої зовнішні (валентні) електрони і перетворюватися на позитивні іони внаслідок низьких значень електронегативностей, які обумовлені невисокими енергіями іонізації атомів і невеликою (часто від'ємною) спорідненістю до електрона.
Прості речовини метали. За звичайних умов це тверді речовини кристалічної будови (крім ртуті) з металічним типом зв'язку. Для них характерні: особливий металічний блиск; висока тепло- та електропровідність; пластична деформація. Кристалічні гратки металів складаються з нейтральних атомів і позитивних іонів, які оточені вільними електронами. Рух електронів відбувається хаотично, подібно до руху молекул газу (рис. 1.1).

Рис. 1.1. Схематичне зображення металічних граток
Більшість металів кристалізується в одному з трьох типів кристалічної гратки (рис.1.2): щільна гексагональна (Mg, Be, Zn), щільна кубічна гранецентрована (Al, Cu, Ag, Au, Ni, γ-Fe), кубічна об’ємноцентрована (лужні метали, Cr, V, Pb, W, α-Fe).

Рис. 1.2. Кристалічні гратки металів: а- кубічна гранецентрована;
б- гексагональна; в - кубічна об’ємноцентрована
Хімічні властивості металів. В хімічних процесах атоми металів можуть тільки віддавати електрони, виконуючи відновлювальну функцію: Meo – nе → Men+
Метали як відновники, взаємодіють з окисниками: неметалами (киснем, галогенами, сіркою, азотом, фосфором), водою, кислотами, солями, інколи лугами. Лужні та лужноземельні метали взаємодіють також з воднем:

Відновлювальна здатність різних металів не однакова. Для реакцій в водних розчинах вона визначається положенням металу в електрохімічному ряді напруг (величиною електродного потенціалу).
При зануренні металічної пластинки у розчин, який має однойменні іони металу, на межі поділу метал – розчин встановлюється рівновага
 ,
,
виникає подвійний електричний шар, різниця потенціалів в якому і називається електродним потенціалом. Абсолютне значення електродного потенціалу виміряти експериментально або розрахувати теоретично неможливо, тому визначають його відносну величину за допомогою електрода порівняння (водневого, каломельного тощо) чи обчислюють за рівнянням Нернста:
 (1)
(1)
де  - стандартне значення електродного потенціалу (при [Men+]=1 моль/л); [Men+] – концентрація іонів металу, моль/л; n – число електронів, що беруть участь в електродному процесі (наприклад, для процесу Fe2++2e-=Fe n=2; для процесу Fe3++e-=Fe2+ n=1); R – універсальна газова стала; T – абсолютна температура; F – число Фарадея.
- стандартне значення електродного потенціалу (при [Men+]=1 моль/л); [Men+] – концентрація іонів металу, моль/л; n – число електронів, що беруть участь в електродному процесі (наприклад, для процесу Fe2++2e-=Fe n=2; для процесу Fe3++e-=Fe2+ n=1); R – універсальна газова стала; T – абсолютна температура; F – число Фарадея.
Для водневого електрода 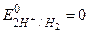 (прийнято в якості міжнародного стандарту). Підставивши в рівняння (1) значення сталих R, F і перейшовши до десяткових логарифмів одержимо (для Т=298 К):
(прийнято в якості міжнародного стандарту). Підставивши в рівняння (1) значення сталих R, F і перейшовши до десяткових логарифмів одержимо (для Т=298 К):
 (2)
(2)
Концентрація іонів металу обчислюється за рівнянням:
[Men+]=С∙ z∙ a
де С – молярна концентрація розчину; z - число іонів металу, що утворюються із однієї молекули електроліту; a - ступінь дисоціації, в частках одиниці.
Значення стандартних електродних потенціалів відносно водневого електрода визначені при 298 К (25ºС) і зведені в таблиці електродних потенціалів (див. Додаток, с.22). Для будь-якої іншої концентрації електроліту електродний потенціал розраховується за рівняннями (1),(2).
Приклад 1. Обчислити потенціал мідного електрода, якщо концентрація CuSO4 – 0,5 моль/л (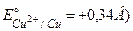 .
.
Розв’язання. Для електродної реакції Cu2++2е-=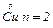 .
.
Концентрація іонів металу [Cu2+]=0,5 моль/л. Тому
 В.
В.
Розмістивши метали у порядку зростання значень їхніх стандартних електродних потенціалів (Додаток, с.22), одержують ряд стандартних електродних потенціалів (електрохімічний ряд напруг металів):
Li, Rb, К, Ва, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb,
H2,