Тема: Уравнения окислительно-восстановительных реакций.
Ключевые слова и словосочетания:
Коэффициент; индекс; степень окисления; процесс окисления; процесс восстановления; вещество-окислитель; вещество-восстановитель.
Прочитайте текст и выполните задания 1 и 2:
Текст:
Правила составления уравнений окислительно-восстановительных реакций такие:
1. Расставляют степени окисления всех элементов до и после реакции и выясняют, у каких элементов изменилась степень окисления. Выписывают эти элементы.
2. Если степень окисления у элемента стала больше, то это значит, что элемент отдал соответствующее число электронов, – окислился; если степень окисления элемента стала меньше, то это значит, что он принял соответствующее число электронов, – восстановился.
3. Количество отданных и принятых электронов в химической реакции должно быть одинаковым. Для этого находят наименьшее общее кратное числу принятых и отданных элетронов. Рассчитывают коэффициенты для элементов, поделив общее кратное на количество электронов, отданных или принятых.
4. Эти коэффициенты расставляют в уравнении реакции перед веществами, в которых элементы поменяли степени окисления, как в левой, так и в правой части уравнения реакции.
5. Вещества, в которых элемент окислился (отдал электроны), называются восстановителями; а вещества, в которых элемент восстановился (принял электроны), называют окислителями.
6. Количество элементов, которые не изменили степени окисления, уравнивают обычным путем.
7. Правильность расстановки коэффициентов, как правило, проверяют по кислороду и водороду, если они не меняли свои степени окисления.
Например, 
Расставляем степени окисления элементов до и после реакции:
+1 -2 +4 -2 0 +1 -2
H2S + SO2 à S + H2O и выписываем элементы, у которых они изменились: -2 0
2 |÷S - 2e- à S - окисление
÷ 4÷ +4 0
1÷÷S + 4e- à S - восстановление
Сбалансируем число отданных и принятых электронов – наименьшее общее кратное для 2 и 4 равно 4, значит, коэффициенты соответственно будут равны 2 и 1. Эти коэффициенты расставляем в левой части уравнения. В правой части перед веществом серы поставим общий коэффициент 2+1=3, затем уравняем количество атомов водорода:
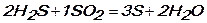
Коэффициент 1 можно не ставить.
Здесь вещество  - восстановитель, а вещество
- восстановитель, а вещество  - окислитель. Такая реакция называется межмолекулярная о-в реакция – окислитель и восстановитель разные молекулы.
- окислитель. Такая реакция называется межмолекулярная о-в реакция – окислитель и восстановитель разные молекулы.
Если окислитель и восстановитель находятся внутри одной молекулы, то реакцию называют внутримолекулярная о-в реакция.
Например: +2 -2 0 0
а) HgO à Hg + O2
+2 0