Divide;Hg + 2e- à Hg
-2 0
1 ÷ 2O - 4e-à O2
+2 -2
Hg – окислитель , O – восстановитель.
2 HgO = 2Hg + O2 - внутримолекулярная о-в реакция.
-3 +3 0
б) NH4NO2 à N2 + 2H2O
+3 0
N + 3 e- à N - восстановление
-3 0
N - 3 e- à N - окисление
N2
Ион NH4+ - восстановитель, ион NO2- - окислитель. Реакция
внутримолекулярная.
Если один элемент меняет свою степень окисления на большую (окисляется) и на меньшую (восстанавливается), то такую реакцию называют о-в реакция диспропорционирования.
Например: 0 -1 +5
Br2 + KOH à KBr + KBrO3 + H2O
0 -1
5 ÷ Br + 1 e- à Br - восстановление
0 +5
1 ÷ Br - 5 e- à Br - окисление
6 Br0
Br2 - окислитель и восстановитель.
Задание 1. Расставьте степени окисления элементов, составьте электронный баланс, укажите процесс окисления и процесс восстановления; расставьте коэффициенты; укажите вещество-окислитель и вещество- восстановитель:
1)  ;
;
2)  ;
;
3) 
Задание 2:Укажите, какие реакции окислительно-восстановительные, а какие – нет.
1)  ;
;
2) 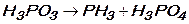 ;
;
3)  ;
;