Реакции в титриметрическом анализе
Реакции, лежащие в основе титриметрических методов, должны удовлетворять ряду требований. Главными из них являются следующие:
1) реакция должна протекать с большой скоростью, иначе нельзя зафиксировать к. т. т.;
2) реакция титрования должна протекать количественно, т.е.быть практически необратимой;
3) реакция должна протекать стехиометрично;
4) должен существовать способ, позволяющий определять окончание титрования, т.е. возможность зафиксировать к. т. т.;
5) не должно идти побочных реакций с титрантом и другими компонентами раствора
6) раствор титранта должен быть стандартизирован;
Классификация титриметрических методов анализа по реакции, лежащей в основе определения:
1) кислотно-основное титрование (основано на реакции нейтрализации:
Н+ + ОН- = Н2О);
2) осадительное титрование (основано на реакциях осаждения);
3) комплекеометрическое титрование (основано на реакциях комплексообразования);
4) окислительно-восстановительное титрование основано на ОВР (окислительно-восстановительных реакциях).
6.6 Процесс и способы титрования
В процессе титрования в растворе протекает химическая реакция между определяемым веществом и титрантом. Состав раствора в ходе титрования непрерывно меняется. При этом различают 4 этапа титрования, на каждом из них состав раствора различен.
1. До начала титрования - в растворе есть только определяемое вещество в начальной концентрации.
2. До т. э. - количество прибавленного в раствор титранта меньше, чем исходное количество определяемого вещества. Следовательно, часть вещества прореагирует с титрантом, а часть останется неоттитрованной. В растворе присутствуют остаток определяемого вещества и продукты реакции. В пределах этого этапа по мере титрования меняется и количественный состав раствора.
3. Т. э. - при сливании эквивалентных количеств определяемого вещества и титранта после протекания реакции в растворе остаются только продукты реакции.
4. После т. э. - при дальнейшем добавлении титранта в растворе присутствуют продукты реакции и непрореагировавший избыток титранта. В пределах этого этапа по мере титрования также меняется количественный состав раствора.
Обычно проводят не одно титрование, а несколько параллельных. При этом можно использовать один из двух приемов:
1. Метод от дельных навесок - берут серию близких точных навесок вещества (3-5), переносят в колбы для титрования, разбавляют произвольным количеством воды и титруют. Результаты определения массовой доли вещества в пробе усредняют.
2. Метод пипетирования - берут одну точную навеску, растворяют в мерной колбе, отбирают пипеткой аликвотные части этого раствора и титруют. Усредняют объемы титранта, пошедшие на титрование, и проводят расчет результатов анализа.
Титрование можно проводить, используя различные способы.
1. Прямое титрование — определяемое вещество В титруют раствором титранта Т.
Схема реакции титрования:В +Т = Р. Закон эквивалентов для растворов прореагировавших веществ:
Сэкв. (В) . V (В) = Сэкв. (Т) . V(Т)
Надо иметь: I рабочий раствор.
Применяется, если выполняются все требования к реакциям в титриметрии.
2. Обратное титрование (титрование по остатку) - к определяемому веществу В добавляют заведомо избыточный, но точно отмеренный объем первого рабочего раствора, дают реакции пройти до конца, а затем титруют остаток этого рабочего раствора вторым рабочим раствором.
Схема титрования:В + Т1 (избыток) = Р1 + Т1 (остаток)
Т1 (остаток) + Т2 = Р2 .
Закон эквивалентов для растворов титранта и титруемого вещества:
Сэкв. (Т1) . V (Т1) = Cэкв.(В) . V(В) + Cэкв.(Т 2) . V(В2)
Надо иметь: 2 рабочих раствора.
Применяется, если реакция протекает медленно, нет подходящего индикатора или наблюдаются побочные эффекты, например потери вещества за счет летучести.
3. Титрование заместителя (способ замещения) к определяемому веществу добавляют неточно отмеренный избыток вспомогательного раствора, дают реакции пройти, затем титруют продукт реакции (заместитель) рабочим раствором.
Схема титрования:
В+ Т1(избыток) = ВТ1 + Т1 (остаток)
Р1 +Т2 = P2
Закон эквивалентов: Сэкв. (В) . V (В) = Cэкв.(Т2) . V(Т2) = nэкв.(ВТ1)
Надо иметь: 1 рабочий раствор и 1 вспомогательный раствор. Применяется в тех же случаях, что и обратное титрование.
Точность вычислений
Она не может быть выше, чем позволяют измерительные приборы, поэтому чаще всего представляют результаты расчетов в следующем виде:
а) концентрация - с точностью до 4 значащих цифр; б) масса, г - с точностью 4-5 знаков после запятой (в зависимости от марки весов); в) массовая доля, % - с точностью 2 знака после занятой.
6.7 Общие сведения о кривых титрования
Кривая титрования - это графическая зависимость измеряемого параметра титруемого раствора, зависящего от концентрации титруемого вещества, от объема прибавленного титранта или степени оттитрованности раствора.
Степень оттитрованности раствора – это отношение объема раствора титранта Vт, добавленного к данному моменту к объему титранта Vт.э, необходимого для завершения реакции титрования (эквивалентному объему): F = Vт / Vт.э или выраженная в процентах: F(%) = Vт . 100%/Vт.э
Бывают линейные и логарифмические кривые титрования. Линейные кривые возникают в том случае, когда величина измеряемого параметра пропорциональна концентрации определяемого вещества, титранта или продукта реакции титрования в титруемом растворе (спектрофотометрическое, амперометрическое титрование).
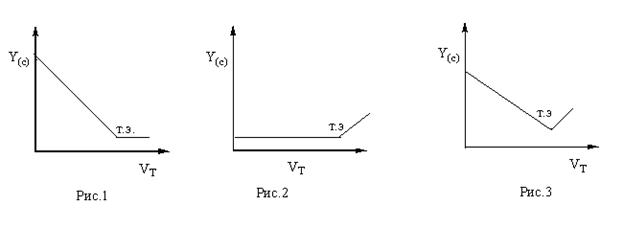
Графическое изображение линейных кривых титрования представлено на рисунках 1 – 3.
На оси ординат откладываются значения величины измеряемого параметра (плотность поглощения, сила тока) пропорционального концентрации определяемого вещества, т.е.
Y = k . c , где Y – измеряемый параметр, c – концентрация определяемого вещества или титранта k – константа, связывающая эти величины, на оси абсцисс – объем раствора прибавленного титранта, от которого линейным образом зависит концентрация определяемого вещества и титранта.
На рис.1 изображена кривая, соответствующая зависимости величины параметра от концентрации определяемого вещества, на рис.2 – от концентрации титранта, на рис.3 – от концентрации как определяемого вещества, так и титранта.