Правильно подобранным является индикатор, интервал перехода окраски которого, полностью входит в границы скачка на построенной кривой титрования
Ошибка титрования.
При титровании слабой кислоты может возникнуть гидроксидная (рТ > рН т.э.) или кислотная, обусловленная наличием в растворе неоттитрованной кислоты (рТ < рН т.э.).
Гидроксидная ошибка в процентах к исходному количеству кислоты или щелочи (относительная ошибка) составляет:
δОН- = 2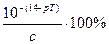 .
.
Кислотная ошибка в процентах к исходному количеству кислоты (относительная ошибка) рассчитывается по формуле:
δНА = 10рК – рТ . 100% .
7.5 Титрование смеси кислот (оснований)
Раздельное титрование смеси кислот (оснований) возможно, если значения их констант диссоциации различаются более чем в 104 раз. Поскольку скачок на кривой титрования наблюдается, если Kдиc. титруемых кислот (оснований) >10-7, то для раздельного определения смеси кислот (оснований) необходимо, чтобы соблюдались следующие условия:
К1/К2>104; К1, К2>10-7
Кривая титрования имеет свои особенности:
а) скачок титрования сильной кислоты заметно уменьшен, так как в 1-й т. э. сильная кислота оттитрована полностью. рН определяется присутствием неоттитрованной слабой кислоты и рассчитывается по формуле:
рН= 0,5pKк - 0,5 lgCк =  рКк +
рКк +  рСк =
рСк =  (-lgKк - lgCk)= -
(-lgKк - lgCk)= - lg Ka. Ck = -(lg
lg Ka. Ck = -(lg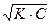 )
)
Чем меньше константа диссоциации и концентрация слабой кислоты, тем резче скачок титрования вблизи 1-й т. э.;
б) после 1-й т. э. наблюдается более плавное изменение pН, так как в растворе присутствует буферная система (слабая кислота и ее соль).
Значение рН во 2-й т. ч. определяется гидролизом соли слабой кислоты:
Выбор индикатора проводят исходя из значений рН в т. э.
Титрование многоосновных кислот
Диссоциация многоосновных кислот протекает ступенчато, причем каждая из ступеней характеризуется своей константой диссоциации. Например, при титровании кислоты Н2А с погрешностью не более 0,1%, в зависимости от соотношения констант диссоциации кислоты по ступеням, возможны 2 варианта.
1. Если отношение констант диссоциации К1/К2> 104 , то титрование идет последовательно (ступенчато). Сначала практически полностью оттитровывается кислота по 1-й ступени, а затем по 2-й. В
этом случае на кривой титрования наблюдается два скачка, т. е. двухосновная кислота выступает как смесь двух одноосновных кислот
(например, H2SO3).
2. Если отношение констант диссоциации K1/K2< 104 двухосновная кислота титруется одновременно по двум ступеням и на кривой титрования наблюдается один скачок, соответствующий суммарному титрованию кислоты по 1-й и 2-й ступеням диссоциации (например, Н2С2О4).
Рассмотрим расчет кривой титрования миогоосновной кислоты сильным основанием на примере Н3РО4.
Н3РО4 является трехосновной кислотой, диссоциирует по 3 ступеням, каждая из которых характеризуется следующими константами диссоциации:
Н3РО4, + NaOH = NaH2PO4 + H2O К1 =7,1 . 10-3
NaH2PO4 + NaOH = Na2HPO4 + H2O K2 =6,2 . 10-8
Na2HPO4 + NaOH = Na3PO4 + Н2О K3 = 5,0 . 10-13.
Отношение K1/K2 ~ 105 и K2/K3 105 но K3 < 10-8, поэтому на кривой титрования наблюдается только два скачка, несмотря на то, что H3PO4 является трехосновной кислотой. Первый скачок соответствует оттитровыванию кислоты по 1-й ступени, а второй скачок - по 2-й ступени.
7.6 Расчет рН раствора в различные моменты титрования
1) до начала титрования.. В растворе находится H3РO4 в исходной концентрации. рН определяется диссоциацией Н3РО4. Поскольку К1>К2>К3, то можно пренебречь диссоциацией кислоты по 2-й и 3-й степеням и рассматривать H3PO4 как одноосновную кислоту. рН рассчитывается по формуле:
рН =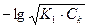 = 0,5 рК1 - 0,5 lgCk =
= 0,5 рК1 - 0,5 lgCk =  рК1 -
рК1 -  lgCk
lgCk
2) до 1-ой т.э. В растворе находятся неоттитрованная. Н3PO4, ее соль NaH2PO4 и Н2О. рН определяется присутствием буферной системы - слабой кислоты и ее соли: pH = pK1 - lg(Ck/Ccоли)
3) 1-я т. э. В растворе находится соль слабой кислоты NaН2PO4, являющаяся амфолитом. рН определяется по формуле pH = 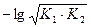 = 0,5pK1 + 0,5pK2 =
= 0,5pK1 + 0,5pK2 =  pK1 +
pK1 +  pK2
pK2
4) до 2-й т.э. В растворе находятся 2 соли фосфорной кислоты различной степени замещенности (NaH2PO4 и Na2НPO4), т. е. буферная система. Расчет рН ведут по формуле:
pН = рК2 - 1g [NaH2PO4]/[Na2HPO4];
5) 2-я т.э. В растворе находится соль Na2НPO4, являющаяся амфолитом. рН определяется по формуле:
pH = 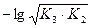 = 0,5pK2 + 0,5pK3;
= 0,5pK2 + 0,5pK3;
6) до 3-й т. э. В растворе находятся 2 соли различной степени замещенности (Na2HPO4 и Na3PO4), т. е. буферная система. Расчет рН ведут по формуле:
pН = рК3 - lg [Na2HPO4]/[Na3PO4];
7) 3-я т. э. В растворе находится соль Na3PO4. pН раствора определяется гидролизом этой соли и рассчитывается по формуле:
pH = 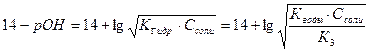 = 7 + 0,5pK3 + 0,5 . lgCcоли
= 7 + 0,5pK3 + 0,5 . lgCcоли
8) после 3-й т.э. В растворе находятся соль Na3PO4 и избыток NaOH, который подавляет гидролиз соли. рН определяется избытком титранта и рассчитывается по формуле pH=14 + lg[OH-].