Решение типовых задач
1. а) Определить молярную массу эквивалента Na3PO4 при титровании стандартным раствором HCl с индикатором метиловым оранжевым.
б) Определить молярную концентрацию эквивалента титруемого раствора Na3PO4 , если на титрование 100 мл этого раствора понадобилось 300 мл 0,1 М раствора НСl.
Решение:
а) При титровании соли Na3PO4 раствором НСl в присутствии метилового оранжевого протекает реакция:
Na3PO4 + 2НСl = NaH2PO4 + 2NaCl
Как можно видеть, 1 моль Na3PO4 соответствует 2 ионам водорода в данной реакции, следовательно, 1/2 Na3PO4 - условная частица, химически эквивалентна одному иону Н+, следовательно, fэкв.( Na3PO4) = 1/2, а молярная масса эквивалента Na3PO4 равна: М(1/2 Na3PO4 ) = Мэкв.( Na3PO4 ) =
М( Na3PO4 ) . fэкв.( Na3PO4 ) = 163,941 . 1/2 = 81,971 г/моль экв.
б) Молярная концентрация соляной кислоты равна нормальной, так как молекула НСl содержит один ион водорода и фактор эквивалентности в реакциях ионного обменя для нее равен единице. Мэкв.(НСl) = М(НСl), Сэкв.(НСl) = СМ(НСl). По закону эквивалентов:
nэкв.( Na3PO4 ) = nэкв.(HCl) или для растворов реагирующих веществ: Сэкв.( Na3PO4 ) . V( Na3PO4 ) = Cэкв. (HCl) . V(HCl), откуда: Сэкв.( Na3PO4 ) = Сэкв.(НСl) . V(HCl)/V( Na3PO4 ) = 300 . 0,1/100 = 0,3 моль экв/л. Ответ: 0,3 моль экв./л.
2. На реакцию смеси, состоящей из карбонатов натрия и калия, массой 0,4000 г израсходовали 22,00 мл 0,3000 М раствора НCl. Вычислить массовую долю (%) карбоната натрия и карбоната калия в смеси.
Решение: Согласно уравнению
Na2CO3 + 2HCl = 2NaCl + H2O + CO2
одному молю водорода соответствует условная частица 1/2(Na2CO3), т.е. fэкв.(Na2CO3) = 1/2.
В точке эквивалентности (т.э.)
n(Na2CO3) + n(K2CO3) = n(HCl),
где n(HCl) = C(HCl) . V(HCl)/1000 - число молей HCl, затраченное на титрование.
Если через х обозначить массовую долю (%) Na2CO3 в смеси, то число молей эквивалентов К2CO3 и Na2CO3 , содержащееся в навеске равно:
n(1/2Na2CO3) =m(смеси) . х /(Мэкв.(Na2CO3) . 100);
n(1/2K2CO3) = m(смеси) . (100 - х) /(Мэкв.(К2CO3) . 100).
Сочетание этих соотношений дает:
m(смеси) . х /(Мэкв.(Na2CO3) . 100) + m(смеси) . (100 - х) /(Мэкв.(К2CO3) . 100) = C(HCl) . V(HCl)/1000.
Подставляя числовые значения, получаем:
0,4000 . х/(52,9942 . 100) + 0,4000 . (100 - х)/(69,103 . 100) = 0,3000 . 22,00/1000;
х = 46,12% Na2CO3; 100 - 46,12 = 53,88% К2CO3.
3. Рассчитайте процентное содержание поваренной соли в пищевом продукте, если на титрование водной вытяжки, полученной при настаивании 100 мл воды с 2,72 г продукта, израсходовано 7,50 мл 0,051N раствора AgNO3.
Решение:
Уравнение реакции метода осадительного титрования:
NaCl + AgNO3 = NaNO3 + AgCl (осадок);
процентное содержание (массовая доля) равно:
W = m(NaCl) . 100%/m(продукта); m(NaCl) рассчитаем по результатам осадительного титрования используя закон эквивалентов и учитывая, что фактор эквивалентности хлористого натрия и азотнокислого серебра равен единице, а это означает, что величины молярных концентраций растворов этих веществ равны нормальным концентрациям: С(NaCl)=С(AgNO3) . V(AgNO3) / V(NaCl);
m(NaCl) = С(NaCl) . V(NaCl) . M(NaCl) = С(AgNO3) . V(AgNO3) . V(NaCl) . M(NaCl) / V(NaCl) = С(AgNO3) . V(AgNO3) . M(NaCl) ;
W = 100% . С(AgNO3) . V(AgNO3) . M(NaCl)/m(продукта) = 100% . (0,051моль/л . 0,0075л . 58,5г/моль)/2,72г = 0,82%. Ответ 0,82%.
4. Для титрования навески образца гидроксида натрия (NaOH) массой 0.1281г, содержащего некоторое количество карбоната натрия (Na2CO3) в качестве примеси, было израсходовано при использовании фенолфталеина в качестве индикатора 23,90 мл 0,1295 М НСl. Рассчитайте массовую долю карбоната натрия в данном образце, если для титрования такой же его навески с метиловым оранжевым было израсходовано 24,40 мл этого же раствора НСl.
Решение.
При титровании данной смеси с фенолфталеином протекают реакции: NaOH + HCl = NaCl + H2O; Na2CO3 + HCl = NaHCO3 + NaCl. При использовании метилового оранжевого реакция взаимодействия гидроксида натрия с кислотой протекает точно также, а карбонат натрия титруется до угольной кислоты. Разность между объемами раствора титранта, израсходованного для титрования в присутствии метилового оранжевого и фенолфталеина, соответствует реакции: NaHCO3 + HCl = H2CO3 + NaCl. Фактор эквивалентности гидрокарбоната натрия (NaHCO3) в данной реакции равен 1. Если принять, что NaHCO3 в исходной смеси не было, то количество молей гидрокарбоната натрия равно первоначальному количеству молей карбоната натрия и по результатам двух титрований: n(NaHCO3) = nо(Na2CO3) = С(HCl) . (Vмо(HCl) - Vф(HCl)) 10-3, где Vмо(HCl) и Vф(HCl) - объемы соляной кислоты, использованной для титрования с метиловым оранжевым и фенолфталеином соответственно; w (Na2CO3) = m (Na2CO3)/mнавески = n(Na2CO3) . M(Na2CO3) . 100% /mнавески. Подставив вместо n(Na2CO3) его выражение через концентрацию и объемы использованной для титрования соляной кислоты, получим: w(Na2CO3) = С(HCl). (Vмо(HCl) - Vф(HCl)) . 10-3 . M(Na2CO3) /mнавески = 0,1295 . (24,40 - 23,90) . 10-3 . 105,989 . 100%/0,1281 = 5,36%.
5. Вывести формулу для расчета рН в точке эквивалентности при титровании слабой кислоты сильным основанием.
Решение.
В т.э. в растворе находится соль, образованная слабой кислотой и сильным основанием, которая подвергается гидролизу. В ионном виде уравнение гидролиза аниона слабой кислоты: А- + Н2О = НА + ОН-
Выражение для константы гидролиза:
Кг= 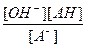 ; так как [ОН-]= [АН] , то [ОН-]2 = Кг . [А-] , прологарифмируем это выражение : lg[OH-]2 =2 . lg[OH-] = Kг . [A-], тогда рОН = - lg[OH-] =
; так как [ОН-]= [АН] , то [ОН-]2 = Кг . [А-] , прологарифмируем это выражение : lg[OH-]2 =2 . lg[OH-] = Kг . [A-], тогда рОН = - lg[OH-] =  pKг -
pKг -  lg[A-]
lg[A-]
Очевидно, что концентрация аниона слабой кислоты будет равна концентрации образовавшейся соли, которая полностью диссоциировала в растворе, за вычетом той части анионов, которая подверглась гидролизу: [A-] = Ссоли – [HA]. Так как количество анионов, подвергшегося гидролизу невелико, можно в разности пренебречь величиной [НА] и тогда [A-] = Ссоли; тогда рОН =  pKг -
pKг -  lgСсоли. Так как Кг = Кводы/Кдисс. =
lgСсоли. Так как Кг = Кводы/Кдисс. =
10-14/Кдисс., то рОН = 7 -  pKд -
pKд -  lgСсоли. В тоже время рН = 14 – рОН = 14 – (7 -
lgСсоли. В тоже время рН = 14 – рОН = 14 – (7 -  pKд -
pKд -  lgСсоли) = 7 +
lgСсоли) = 7 +  pKдисс. +
pKдисс. +  lgСсоли.
lgСсоли.
6. На титрование 100 мл смеси соляной и фосфорной кислоты 0,1 н раствором гидроксида натрия с использованием в качестве индикатора метилового оранжевого (рТ = 4,0) потребовалось 200 мл раствора титранта. На титрование такого же количества смеси тем же титрантом с использованием в качестве индикатора фенолфталеина (рТ = 9,0) потребовалось 300 мл раствора титранта. Определить молярные концентрации соляной и фосфорной кислот в смеси.
Решение.
Уравнения реакций титрования c метиловым оранжевым:
HCl + NaOH = NaCl + H2O
H3PO4 + NaOH = NaH2PO4 + H2O
Уравнения реакций титрования c фенолфталеином:
HCl + NaOH = NaCl + H2O
H3PO4 + 2NaOH = Na2HPO4 + 2H2O
Соляная кислота – сильная кислота и, поэтому оттитровывается полностью в обоих вариантах. Фосфорная кислота – слабая кислота и, поэтому при использовании метилового оранжевого (кислая среда) оттитровывается по первой стадии (с образованием дигидрофосфата натрия), а с фенолфталеином (основная среда) – по двум стадиям (с образованием гидрофосфата натрия).
Соляная кислота – одноосновная кислота, поэтому ее молярная концентрация в растворе равна нормальной концентрации. Фосфорная кислота в первом случае реагирует как одноосновная, поэтому ее молярная концентрация равна нормальной, а во втором случае как двухосновная, поэтому ее нормальная концентрация в два раза больше молярной (число эквивалентности равно двум).
Используем закон эквивалентов для составления двух алгебраических уравнений соответствующих двум вариантам титрований:
Nэкв. (NaOH) = nэкв. (HCl) + nэкв. (H3PO4) или для растворов реагирующих веществ
Cэкв. (NaOH) ּV (NaOH) = [Cэкв. (HCl) + Cэкв. (H3PO4)] ּV (HCl+H3PO4)
Пусть х – молярная концентрация (равная нормальной) соляной кислоты в смеси, а y – молярная концентрация фосфорной кислоты. Тогда Cэкв. (H3PO4) = у в первом случае и Cэкв. (H3PO4) = 2у – во втором. Уравнения закона эквивалентов первого (1) и второго (2) вариантов титрования:
Cэкв. (NaOH) ּV1 (NaOH) = (x + y) ּV (HCl+H3PO4) (1)
Cэкв. (NaOH) ּV2 (NaOH) = (x + 2y) ּV (HCl+H3PO4) (2)
Подставим соответствующие значения объемов и концентраций:
0,1 ּ 200 = (х + у) ּ 100 (1)
0,1 ּ 300 = (х + 2у) ּ 100 (2)
Сократив оба уравнения на 100, вычтем из второго уравнения первое и получим у = 0,1.
х = 0,2 – у = 0,1.
Ответ: СМ (HCl) = CМ (H3PO4)] = 0,1 моль/л