Условия проведения и аналитические возможности метода
Титрование проводят при пониженной или при комнатной температуре, так как при нагревании улетучивается иод, уменьшается чувствительность индикаторной реакции.
Титрование проводят в нейтральной или слабокислой среде, так как в сильнокислой среде разлагается тиосульфат, окисляются кислородом воздуха иодид-ионы, а в сильнощелочной - диспропорционирует иод.
К титрованию выделившегося иода приступают через 5 мин (из-за низкой скорости реакции).
Реакционную смесь ставят в темноту, так как на свету I- окисляется кислородом воздуха до I2. В результате после титрования может опять появиться синяя окраска иод-крахмального комплекса. (склянки и колбы закрывают (из-за летучести иода).
Иодометрия - весьма универсальный и очень точный метод, позволяющий проводить определение многих веществ:
1. Окислителей (Сr2О72-, Сu2+, H2O2 и др.). В иодометрии применяют растворы восстановителей Na2S2О3 и KI, но прямое титрование ими окислителей невозможно. Реакции между окислителями и Na2S2O3 идут нестехиометрично, а между окислителями и КI медленно.
Поэтому для определения окислителей используют титрование заместителя: окислитель замещают эквивалентным количеством иода, затем титруют выделившийся иод раствором тиосульфата:
Окислитель + I- + Н+ → Восстановитель + I2 + Н2О
I2+2S2O32- → 2I- + S4O62-.
Рабочий раствор - Na2S2O3; вспомогательные.растворы - КI и H2SO4: индикатор крахмал добавляют вблизи т. э.
2. Bосстановителeй (S2O32-, SO32-, NO2-, , НСОН и др.). Прямое титрование раствором I2 в нейтральной или слабокислой среде используют для достаточно сильных восстановителей. Крахмал добавляют до начала титрования. Титруют до появления окраски.
Обратное титрование избытка I2 раствором Na2S2O3 используют для восстановителей, значение Е° которых близко к Е° (I2/I-) , поскольку они труднее окисляются, реакция идет недостаточно полно при прямом титровании:
А(восстановитель) + I2(избыток) → А*(окисл.форма) + I2(остаток) + I-
I2(остаток) + 2S2O32- → 2I- + S4O62-.
3. Bеществ, не обладающиx окислительно-восстановительными свойствами, но реагирующиx с окислителями или восстановителями (Ва2+, Zn2+, Pb2+, Ag+ и др.). Иодометрически можно определять ионы металлов, которые осаждаются в виде сульфидов или хроматов. Схемы анализа:
а) Осаждают ион металла в виде сульфида, растворяют осадок в
НС1 в присутствии избытка I2 и титруют остаток I2 после реакции раствором Na2S2O3:
Ме2+ + S2- → MeS (осадок)
MeS + 2HC1 → МеС12 + H2S
H2S + I2(избыток) → 2HI + S + I2(остаток)
I2(остаток) + S2O32- →
б) Осаждают ион металла в виде хромата, растворяют осадок в
кислоте. Затем продукт реакции — Сг2О72- определяют иодометрически как любой другой окислитель:
Ме2+ + CrO42- → МеСrO4(осадок)
2МеСrО4 + 2H+ → Cr2O72- + Н2О + 2Ме2+
4. Oрганическиx веществ (нафтол, аскорбиновая кислота, муравьиная кислота и др.).Используют вес способы титрования: Прямое титрование раствором I2.
Обратное титрование остатка I2 после реакции с органическим веществом раствором Na2S2O3 используют чаще всего:
Органическое вещество + I2(избыток) + ОН- → (щелочная среда)
I2(остаток) + S2O32- → (слабокислая среда)
Особенность этого титрования заключается в следующем. В кислых растворах I2 не реагирует с органическими веществами или реагирует очень медленно. Поэтому сначала проводят реакцию в щелочной среде, затем раствор подкисляют и титруют.
Титрование заместителя используют, если органическое вещество обладает свойствами окислителя.
5. Kислот (сильныx и слабыx с Ка > 10-6).
8.9 Решение типовых задач
1. Определить, может ли самопроизвольно протекать в стандартных условиях реакция окисления-восстановления иодид-ионов ионами Fe3+.
2Fe3+ + 2I- = Fe2+ + I2
Решение.
а) Находим разность между стандартным электродным потенциалом пары окислителя Е0Fe3+/Fe2+ и восстановителя Е0(I2/I-): ∆Е0= Е0(Fe3+/Fe2+) - Е0(I2/I-) = 0,771 - 0,536 = 0,235B.
Данная реакция может самопроизвольно протекать в прямом направлении, потому что разность потенциалов окислителя и восстановителя величина положительная (больше нуля).
б) Определим константу равновесия данной реакции в стандартных условиях по формуле:
lgK = 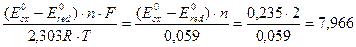 , тогда К = 107,966
, тогда К = 107,966
Данная реакция может протекать в прямом направлении и константа равновесия составляет восемь порядков.
2. Определить молярную массу эквивалента окислителя и восстановителя в реакции:
5H2C2O4 + 2KMnO4 + 3H2SO4 = K2SO4 + 2MnSO4 + 10CO2 + 8H2O
Решение: Запишем уравнение полуреакции, соответствующей превращению окислителя
MnO4- + 8H+ + 5e- = Mn2+ + 4H2O
и восстановителя
H2C2O4 - 2e- = 2CO2 + 2H+
Из уравнений видим, что перманганат-ион восстанавливается до Mn2+, принимая пять электронов, следовательно, одному электрону соответствует частица равная 1/5 перманганат-иона, а это и есть фактор эквивалентности fэкв.(MnO4-) = fэкв.(KMnO4) = 1/5.
Так как Мэкв. = М . fэкв., то Мэкв.(KMnO4) = fэкв.(KMnO4) . M(KMnO4) = 1/5 . 119 = 24 г/моль экв.
Аналогично, одному электрону соответствует 1/2 молекулы щавелевой кислоты, значит: fэкв. (H2C2O4) = 1/2,
Мэкв.(H2C2O4) = fэкв. (H2C2O4) . M (H2C2O4) = 1/2 . 90 =45 г/моль экв.
3. Вычислить величину окислительно-восстановительного потенциала системы в точке эквивалентности (т.э.) при титровании 0,1 н раствора FeSO4 0,1 н раствором KMnO4 (fэкв. = 1/5) при рН =0.
Решение:
Уравнение реакции титрования: 10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + K2SO4 + 2MnSO4 +8H2O
Так как рН равен нулю, а значит равновесная концентрация ионов водорода (Н+) равна 1 моль/л, то значение окислительно-восстановительного потенциала можно вычислить по упрощенной формуле, в которой Е не зависит от lg[H+] = -pH = lg1 =0:
Eт.э. = (n1Е°1 + n2Е°2)/(n1 + n2)
В этом уравнении Е°1 и Е°2 - значения стандартных окислительно-восстановительных потенциалов потенциалов пар при рН = 0; n1 и n2 - число принятых и отданных электронов в соответствующих полуреакциях:
MnO4- + 8H+ + 5e- = Mn2+ + 4H2O; Е°1 = 1,51 B; n1 = 5
Fe2+ - e- = Fe3+; Е°2 = 0,77 B; n2 = 1
Подставляем числовые значения и получаем величину Е:
Е = (5 . 1,51 + 1 . 0,77)/6 = 1,39 В.
4. Стандартизация раствора тиосульфата натрия. Стандартный раствор тиосульфата натрия является вторичным, поэтому его точную концентрацию определяют титрованием стандартным раствором с точно известной концентрацией. В качестве первичного стандартного вещества для его стандартизации используют дихромат калия. Протекание реакции Na2S2O3 c K2Cr2O7 зависит от различных факторов и не может быть описано одним определенным уравнением, поэтому для стандартизации раствора Na2S2O3 используют не прямое титрование раствором K2Cr2O7, а титрование стандартизируемым раствором Na2S2O3 иода, образовавшегося в процессе реакции K2Cr2O7 с КI в кислой среде (титрование заместителя): K2Cr2O7 + 6KI + 7H2SO4 = 3I2 + Cr2(SO4)3 + 4K2SO4 + 7H2O; I2 + 2Na2S2O3 = 2NaI + Na2S4O6.
а) Вывести формулу для расчета молярной концентрации тиосульфата натрия по данной методике, если известно, что для приготовления 100 мл раствора дихромата взяли навеску массой m грамм соли, а для реакции с иодидом калия и последующего титрования раствором тиосульфата использовалась аликвота раствора дихромата объемом 10 мл.
б) Вычислить концентрацию стандартизируемого раствора тиосульфата натрия, если масса навески дихромата калия составила 0,245г, а объём раствора тиосульфата использованного для титрования выделившегося иода составил 10мл.
Решение.
а) Очевидно из уравнения реакции, что количество выделившегося иода эквивалентно количеству дихромата калия, вступившего в реакцию. Остаток иодида калия, добавленного в избытке, в реакцию с тиосульфатом не вступает. Вычислим молярную концентрацию эквивалентов, приготовленного стандартного раствора дихромата калия. Из уравнения полуреакции восстановления следует, что одна молекула дихромата принимает шесть электронов, значит его фактор эквивалентности равен 1/6 (fэкв.), а fэкв.(Na2S2O3) = 1:
Cr2O72- + 6е- + 14Н+ = 2Cr3+ + 7H2O; 2S2O32- - 2e- = S4O62-; Mэкв.(K2Cr2O7) = 1/6 M(K2Cr2O7); Cэкв.(K2Cr2O7) = 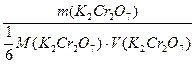 = m/[(1/6М(K2Cr2O7)) . V(K2Cr2O7)] = m(K2Cr2O7)г/[1/6 . (294,185г/моль . 0,1л)] =
= m/[(1/6М(K2Cr2O7)) . V(K2Cr2O7)] = m(K2Cr2O7)г/[1/6 . (294,185г/моль . 0,1л)] = 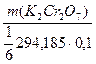
Из закона эквивалентов следует: Сэкв. = Сэкв.(K2Cr2O7) . V(K2Cr2O7)/V(Na2S2O3) = [m/(1/6М(K2Cr2O7) . Vo(K2Cr2O7))] . V(K2Cr2O7)/V(Na2S2O3) = [m(K2Cr2O7)/4,903]моль экв./л . 10мл/V(Na2S2O3)мл.
б) Подставляем в выведенную нами формулу: С(Na2S2O3)=0,245/4,903 . (10/10) = 0,05моль/л.