Кривые комплексонометрии и способы установления конечной точки титрования (к. т. т.)
При построении кривых титрования используют понятия условных констант устойчивости комплексонатов, условных концентраций определяемого металла и лиганда. Необходимость в этом обусловлена тем, что титрование часто проводят в присутствии аммиака для поддержания определенного рН раствора, а он образуем аммиачные комплексы, поэтому концентрация свободных ионов металла в титруемом растворе не включенных в комплексонат будет значительно меньше, количества связанных в аммиачные комплексы. Кроме того, ЭДТА – это четырехосновная кислота и концентрация лиганда Y4- зависит от рН раствора, т.е. она меньше, чем количество лиганда не связанного в комплексонате в виде: HY3-, H2Y2-, H3Y-, H4Y за счет процессов протонирования и дэпротонирования. Условная концентрация металла [Men+]/ – это суммарная концентрация металла не связанного в комплекс с ЭДТА (МеYn -4), т.е. включающая свободный ион и связанные в комплексе с аммиаком. Условная концентрация лиганда [Y4-]/ – это суммарная концентрация ЭДТА не связанная в комплекс с определяемым металлом, т.е. включающая Y4-, HY3-, H2Y2-, H3Y-, H4Y. Условная константа устойчивости соответствует процессу:
[Men+]/ + [Y4-]/ = [MeYn-4]
и равна 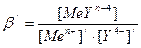 .
.
Отношение условной (кажущейся) концентрации металла к истинной 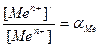 называется коэффициентом побочной реакции, а отношение условной концентрации лиганда к истинной
называется коэффициентом побочной реакции, а отношение условной концентрации лиганда к истинной 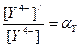 – коэффициентом побочной реакции лиганда.
– коэффициентом побочной реакции лиганда.
Коэффициент побочной реакции рассчитывается с использованием констант устойчивости аммиачных комплексов определяемого металла, коэффициент побочной реакции лиганда – с использованием ступенчатых констант диссоциации ЭДТА и с учетом рН раствора. При фиксированных рН, температуре и концентрации лиганда побочной реакции эти коэффициенты постоянны. С учетом выше сказанного выражение для условной константы устойчивости комплексоната равно:
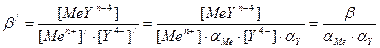 , где β – истинная константа устойчивости комплексоната. Так как при фиксированных рН, температуре и концентрации лиганда побочной реакции условные константы устойчивости постоянны, ими можно пользоваться в расчетах также как и обычными (термодинамическими) константами устойчивости. В тоже время расчеты с использованием условных констант устойчивости менее трудоемки, так как коэффициенты побочных реакций можно рассчитать заранее и табулировать. Кривая комплексонометрического титрования представляет собой график зависимости отрицательного логарифма условной концентрации иона металла рМе/ от объема добавленного раствора ЭДТА или процента оттитрованности (в случае рассчитанной кривой). Расчет условной концентрации металла в момент когда прибавлен объем раствора VY осуществляется с использованием выражения для условной константы устойчивости комплексоната:
, где β – истинная константа устойчивости комплексоната. Так как при фиксированных рН, температуре и концентрации лиганда побочной реакции условные константы устойчивости постоянны, ими можно пользоваться в расчетах также как и обычными (термодинамическими) константами устойчивости. В тоже время расчеты с использованием условных констант устойчивости менее трудоемки, так как коэффициенты побочных реакций можно рассчитать заранее и табулировать. Кривая комплексонометрического титрования представляет собой график зависимости отрицательного логарифма условной концентрации иона металла рМе/ от объема добавленного раствора ЭДТА или процента оттитрованности (в случае рассчитанной кривой). Расчет условной концентрации металла в момент когда прибавлен объем раствора VY осуществляется с использованием выражения для условной константы устойчивости комплексоната:
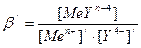 . Обозначим условную концентрацию лиганда [Y4-]/ через х, тогда без учета изменения объема раствора в ходе титрования [MeYn-4] = fּC0 – x, [Men+]/ = [C0 – (fּC0 – x)] x = [C0 + x – fּC0], где f = VY/V0 – степень оттитрованности, С0 – первоначальная концентрация иона металла. В сумме и разности малой величиной х можно пренебречь, тогда
. Обозначим условную концентрацию лиганда [Y4-]/ через х, тогда без учета изменения объема раствора в ходе титрования [MeYn-4] = fּC0 – x, [Men+]/ = [C0 – (fּC0 – x)] x = [C0 + x – fּC0], где f = VY/V0 – степень оттитрованности, С0 – первоначальная концентрация иона металла. В сумме и разности малой величиной х можно пренебречь, тогда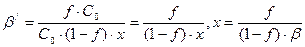
В точке эквивалентности условные концентрации металла и лиганда равны: [Men+]/ = [Y4-]/ = х, тогда 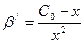 . Так как С0>>x, в разности значением х можно пренебречь. Тогда
. Так как С0>>x, в разности значением х можно пренебречь. Тогда
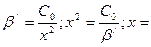

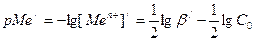 .
.
Истинная концентрация металла в любой точке титрования , включая и область скачка может быть рассчитана с помощью коэффициента побочной реакции αМе:
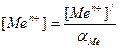 . Например в точке эквивалентности (т.э.) с учетом увеличения объема титруемого раствора концентрация металла будет равна:
. Например в точке эквивалентности (т.э.) с учетом увеличения объема титруемого раствора концентрация металла будет равна:
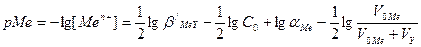 , где V0Mе и VY – первоначальный объем титруемого и эквивалентный объем ЭДТА растворов соответственно. Скачок титрования зависит от констант устойчивости образующихся комплексв в растворе и концентрации реагентов. Чем меньше условная константа устойчивости, тем меньше скачок на кривой титрования. Чем выше концентрация вспомогательного лиганда (например аммиака) и выше устойчивость образованных с ним комплексов, тем меньше будет условная константа устойчивости и тем меньше будет скачок титрования.
, где V0Mе и VY – первоначальный объем титруемого и эквивалентный объем ЭДТА растворов соответственно. Скачок титрования зависит от констант устойчивости образующихся комплексв в растворе и концентрации реагентов. Чем меньше условная константа устойчивости, тем меньше скачок на кривой титрования. Чем выше концентрация вспомогательного лиганда (например аммиака) и выше устойчивость образованных с ним комплексов, тем меньше будет условная константа устойчивости и тем меньше будет скачок титрования.
В комплексонометрическом титровании к.т.т. устанавливают как визуально, так и с использованием инструментальных методов анализа. При визуальном способе установления применяют металлоиндикаторы. Это соединения, которые меняют свою окраску в зависимости от концентрации иона металла (мурексид, эриохром черный и др.).
Обычно это органические соединения, чаще всего - многоосновные кислоты, которые с ионами металлов образуют окрашенные комплексы. В общем случае индикатор считается правильно подобранным, если интервал перехода окраски индикатора полностью или частично перекрывается скачком на кривой титрования. В отличие от кислотно-основного и окислительно-восстановительного титрования, где интервал перехода окраски индикатора не зависит от того, титрование какой кислоты (основания), окислителя (восстановителя) осуществляется, в комплексонометрии границы этого интервала зависят от природы титруемого металла, так как катион металла образует комплексное соединение с индикатором. При добавлении металлоиндикатора к раствору соли металла происходит реакция комплексообразования:
Me2+ + H2Ind ↔MeInd + 2Н+
Если полученный раствор начать титровать раствором ЭДТА, то ион металла из менее устойчивого комплекса с металлоиндикатором будет переходить в более устойчивый комплекс с ЭДТА:
MeInd + H2Y2- ↔ MeY2- +Н2Ind
При этом металлоиндикатор «освобождается» и придает раствору свою окраску. Интервал перехода окраски для трехосновного индикатора (например, эриохром черного Т) рассчитывается по уравнению:
ΔрМe = [-lg([H+]/KHInd2-) + lgβMeInd-] ± 1
Из уравнения следует, что интервал перехода окраски индикатора зависит от рН раствора, последней константы кислотности индикатора и константы устойчивости комплекса индикатора и определяемого металла.
Требования к металлоиндикаторам:
а) металлоиндикатор должен образовывать с ионом металла достаточно устойчивый комплекс состава 1:1;
б) устойчивость комплекса металла с металлоиндикатором должна быть меньше, чем устойчивость комплекса металла с ЭДТА. в 10-10000 раз;
в) комплекс металла с металлоиндикатором должен быстро разрушаться при действии ЭДТА; г) изменение окраски в к. т. т. должно быть контрастным.