Решение типовых задач
1. Определить молярную концентрацию, рабочего раствора ЭДТА (комплексона III), если на титрование навески металлического цинка массой 0,0131 г, растворенного предварительно в кислоте, затратили 18,46 мл этого раствора.
Решение. В соответствии с законом эквивалентов:
n(ЭДТА) = n(Zn) = m(Zn)/M(Zn).
Обозначим молярную концентрацию раствора комплексона III (трилона Б) как С(ЭДТА), тогда количество вещества (моль) титранта выразится как:
n(ЭДТА) = C( ЭДТА) · V( ЭДТА)/1000.
Приравнивая эти выражения, получаем, что молярная концентрация раствора ЭДТА равна:
С(ЭДТА) = m(Zn) ·1000/(M(Zn) · V(ЭДТА)).
Подставляя числовые значения получаем:
С(ЭДТА) = 0,0131 · 1000/(65,38 · 18,46) = 0,01085 моль/л.
2. Вычислить массовую долю (%) СаСОз и МgCOз в известняке, если после растворения 1,000 г его получили 100,0 мл раствора, на титрование 20,00 мл которого для определения суммы Са и Mg с эриохромчерным израсходовали 19,25 мл 0,05140 М ЭДТА, а на титрование Са с мурексидом в отдельной пробе затратили 6,25 мл того же раствора ЭДТА.
Решение: Обозначим через w(СаСОз) массовую долю (%) СаСОз, то по результатам титрования пробы на содержание Са с мурексидом можно записать:
масса Са в пробе (1 г): m(СаСОз) = C(ЭДТА) · V2(ЭДТА) · М(СаСОз) ·Vк/Vп , где C(ЭДТА) - концентрация ЭДТА, V2(ЭДТА) - объем титранта, затраченный на титрование Са, выраженный в литрах, М(СаСОз) - молярная масса СаСОз, Vк/Vп - отношение всего контрольного объёма (100мл) раствора к объёму аликвоты (20 мл), взятой для титрования.
массовая доля равна отношению массы определяемого вещества к массе пробы известняка: w(СаСОз) = mСаСОз) . 100% / m(извест) = C(ЭДТА) . V2 . М(СаСОз)/1000 · Vк/Vп · 100%/m(извест.) = 0,05140 · 0,000625 · 100,9 · (100/20) . (100%/1,000) = 16,08% (СаСОз).
Объём стандартного раствора ЭДТА, затраченный на титрование Мg, найдем как V1 - V2 = 19,5 - 6,25 =13,00 мл = 0,013 л, тогда:
w(MgCOз) = С(ЭДТА) · (V1 -V2) · М(MgCOз) · (Vк/Vп) · 100%/m(извест.) = 0,05140 · 0,013 · 84,314 ∙ (100/20) ∙ (100%/1) = 28,17% (MgCOз).
4. Рассчитать равновесную концентрацию ионов никеля в 0,1 М растворе Ni(NH3)62+. β(Ni(NH3)62+) = 2,0 . 108 , lgβ = 8,31.
Решение:
Уравнение реакции образования комплексного иона: Ni2+ + 6NH3 = [Ni(NH3)6]2+.
Запишем выражение для константы устойчивости комплексного иона:
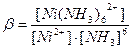 .
.
Из уравнения образования комплекса следует, что при диссоциации (реакции обратной образованию) одного комплексного иона образуется один ион никеля и шесть молекул аммиака. Обозначим значение молярной концентрации ионов никеля за х, тогда концентрация аммиака равна 6х. Подставляем в выражение константы устойчивости значения концентраций всех компонентов
([Ni2+] = x, [NH3] = 6x, [Ni(NH3)6]2+ = 0,1 – x):
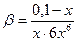 . Так как х<<0,1, то можно принять, что 0,1 – х = 0,1. Тогда
. Так как х<<0,1, то можно принять, что 0,1 – х = 0,1. Тогда
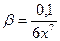 . Для решения уравнения, содержащего неизвестное в седьмой степени прологарифмируем обе части уравнения и с учетом того, что логарифм произведения равен сумме логарифмов получаем: lgβ = lg0,1 – lg6 – 7ּlgx. Откуда:
. Для решения уравнения, содержащего неизвестное в седьмой степени прологарифмируем обе части уравнения и с учетом того, что логарифм произведения равен сумме логарифмов получаем: lgβ = lg0,1 – lg6 – 7ּlgx. Откуда: 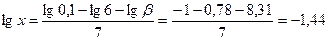 . Откуда: х = 10-1,44 = 0,036 моль/л.
. Откуда: х = 10-1,44 = 0,036 моль/л.