ЗАКОН ЭКВИВАЛЕНТОВ
Все расчеты в химии вообще и в аналитической в частности основаны на законе эквивалентов: Вещества реагируют между собой в эквивалентных количествах.
Эквивалент - это реальная или условная частица вещества, которая эквивалентна:
а) одному иону Н+ или ОН- в данной кислотно-основной реакции; б) одному электрону в данной ОВР (окислительно-восстановительной реакции); в) одной единице заряда в данной реакции обмена, г) количеству монодентатных лигандов, участвующих в реакции образования комплекса.
Молярной массой эквивалента (Mэкв.) вещества называется выраженная в граммах масса одного моля эквивалента этого вещества, т.е. это масса количества вещества эквивалентов равного числу Авогадро (6,02 . 1023).
Химическое количество эквивалентов вещества – количество молярных масс эквивалентов вещества (nэкв.) равно массе вещества (m) деленной на молярную массу эквивалентов этого вещества (Mэкв): nэкв. = m/Mэкв.
Фактор эквивалентности fэкв. — это число, которое обозначает, какая доля реальной частицы эквивалентна одному иону Н+ в данной кислотно-основной реакции, одному электрону в данной ОВР или одной единице заряда в данной реакции обмена. Фактор эквивалентности – это число, на которое необходимо умножить молярную массу вещества, чтобы получить молярную массу эквивалента этого вещества: Мэкв. = М . fэкв.
Число эквивалентности – величина обратная фактору эквивалентности: z = 1/fэкв. На практике число эквивалентности – это число на которое необходимо разделить молярную массу вещества чтобы получить его молярную массу эквивалента: Мэкв. = 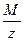 .
.
Очевидно, что если fэкв. = z = 1, то эквивалент совпадает с реально существующей молекулой или формульной единицей вещества немолекулярного строения. Например, в ионообменных реакциях для веществ: HF, HCl, HBr, HI, LiOH, NaOH, KOH, LiF, NaCl, KBr.
Химический эквивалент вещества непостоянен и зависит от типа химической реакции и конкретной реакции, поэтому всегда надо указывать, к какой именно реакции относится эквивалент.
Так, в ионообменных реакциях число эквивалентности кислот равно числу протонов в молекуле, замещаемых на другие катионы, а оснований – числу гидроксильных групп, замещаемых на другие анионы. В частности, для следующих кислот и оснований число эквивалентности может принимать значения: Н3РО4, Al(OH)3 – 1, 2, 3; H2SO4, Mg(OH)2 – 1,2; HCN, RbOH – 1.
Например, факторы (числа) эквивалентности H2SО3 (1) H2S (2) в различных реакциях:
1. а) в кислотно-основной:
H2SО3 + 2КОН = К2SО3 + 2Н2О fэкв.( H2SО3) = ½ , z = 2
H2SО3 + КОН = КHSО3 + Н2О fэкв.( H2SО3) = 1, z = 1;
б) в окислительно-восстановительной:
H2SО3 + Cl2 + Н2О = H2SО4 + 2HCl
SО32- + Н2O - 2e- = SО42- + 2H+ fэкв.( H2SО3) = ½ , z = 2
H2SО3 + 2Н2S = 3S + 3Н2О
SО32- + 6H+ - 4e- = S + 3Н2O fэкв.( H2SО3) = 1/4, z = 4;
2. а) в кислотно-основной:
H2S + NaOH = NaHS + H2O fэкв. = 1, z =1
H2S + 2NaOH = Na2S + 2H2O fэкв = 1/2, z =2;
б) в окислительно-восстановительной:
H2S + 4Cl2 + 4H2O = 8HCl + H2SO4
H2S + 4H2O – 8е- = 10H+ + SO42- fэкв. = 1/8, z = 8
2H2S + SO2 = 3S + 2H2O
H2S + 4H2O – 2е- = 10H+ + SO42- fэкв. = 1/2, z =2.
С учетом выше сказанного, закон эквивалентов для реакции: k1А1 +k2А2 +…kiAi = р1В1 + р2В2 + …рiBi принимает вид:
nэкв.(А1) = nэкв.(А2) = … nэкв.(Аi), (1)
или
m(А1 )/ Mэкв.(А1) = m(А2 )/ Mэкв.(А2) = … m(Аi )/ Mэкв.(Аi)
Если некоторые из реагирующих веществ (например А2) находятся в растворе, то ряд тождеств принимает вид:
m(А1 )/ Mэкв.(А1) = Сэкв. (А2 ) . V(А2) = … m(Аi )/ Mэкв.(Аi).
Закон эквивалентов для растворов реагирующих веществ:
Объемы растворов реагирующих веществ обратно пропорциональны их молярным концентрациям эквивалентов:
. V(А1) : V(А2) : …V(Аi)= 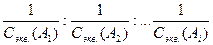 ,
,
где Сэкв. (Аi ) - молярная концентрация эквивалентов прореагировавшего вещества (нормальная концентрация), V(Аi) – объем раствора того же вещества.
Для двух реагирующих веществ следующее уравнение:
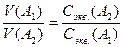 .
.
Так как химическое количество молярных масс эквивалентов равно произведению нормальной концентрации на объем раствора: nэкв. = Сэкв. . V, ряд тождеств (1) принимает вид:
Сэкв. (А1 ) . V(А1) = Сэкв. (А2 ) . V(А2) = … Сэкв. (Аi ) . V(Аi),
Число (фактор) эквивалентности кислот и оснований в ионообменных реакциях, как уже было сказано, соответствует числу замещаемых протонов или гидроксильных анионов в молекуле. Можно вывести уравнение связывающее числа эквивалентности и стехиометрические коэффициенты (ki) всех веществ в химическом уравнении и таким образом создать способ определения числа (фактора) эквивалентности для других соединений данной реакции: k1А1 +k2А2 +…kiAi = р1В1 + р2В2 + …рiBi.
Из закона эквивалентов следует, что вещества реагируют в эквивалентных количествах:
nэк.(А1) = nэк.(А2) = … nэк.(Аi). (1)
В тоже время: nэк.(A) = z(A) . n(A), где nэк.(A) – количество молярных масс эквивалентов вещества А, вступивших в реакцию, z(A) – число эквивалентности вещества А в данной реакции, n(A) – число молей вещества А, вступивших в реакцию.
Из уравнения реакции следует, что:
n(A1)/k1 = n(A2)/k2 = …ni(Ai)/ki или nэк.(А1)/(z1.k1) = nэк.(А2)/(z2.k2) = … nэк.(Аi)/(zi.ki). (2)
Так как nэк.(А1) = nэк.(А2) = … nэк.(Аi), то разделив уравнение (1) на уравнение (2), получаем:
z1.k1 = z2.k2 = … zi.ki.
Данное уравнение позволяет определить число эквивалентности для всех участвующих в реакции веществ, если известно число эквивалентности одного из них.
Например: определить число эквивалентности серной кислоты z1 и сульфата гидроксомеди z2 в реакции: (CuOH)2SO4 + 3H2SO4 = 2Cu(HSO4)2 + 2H2O
Решение:
Очевидно, что число эквивалентности кислот, участвующих в реакциях обмена, равно числу ионов водорода, замещающихся другими катионами в данной реакции.
Так как в результате химической реакции ионного обмена образовался гидросульфат меди Cu(HSO4)2, то очевидно, что в молекуле серной кислоты прошла замена только одного протона на катион меди и значит число эквивалентности равно единице z1=1. Используя уравнения, полученные в предыдущей задаче, определим число эквивалентности сульфата гидроксомеди (CuOH)2SO4 в данной реакции: z1.k1 = z2.k2 или 1.3 = z2.1, тогда z2 = 3.
Если вещество участвует в сложных многостадийных реакциях, то для каждой стадии процесса число (фактор) эквивалентности может быть разным. В случае последовательных реакций число эквивалентности может быть суммарным числом для вещества, участвующего во всех стадиях процесса.
Например, определить число эквивалентности серной кислоты и меди в реакции:
Cu + 2H2SO4 = 2CuSO4 + SO2 + 2H2O
медь и серная кислота участвуют в двух процессах – окисления-восстановления и обмена:
1) Cu + H2SO4 = CuО + SO2 + H2O окисление-восстановление
2) CuO + H2SO4 = CuSO4 + H2O обмен
В окислительно-восстановительном процессе число эквивалентности как меди, так и серной кислоты равно двум, так как один атом меди отдает одной молекуле серной кислоты два электрона. В обменном процессе число эквивалентности оксида меди и серной кислоты тоже равно двум, но во второй стадии участвует оксид меди, образовавшийся в первой, и новая молекула серной кислоты, поэтому для общей реакции эквивалентное число для меди равно их сумме в обеих стадиях (2 + 2 = 4), а для серной кислоты равно двум.
Например, определить число эквивалентности азотной кислоты и цинка в реакции:
Zn + HNO3 → Zn(NO3)2 + N2O + H2O
Цинк и азотная кислота участвуют в двух процессах – окисления-восстановления и обмена. Расставим стехиометрические коэффициенты методом ионно-электронного баланса.
Zn – 2e- → Zn2+ 1 4 окисление
2NO3- + 10H+ + 8e- → N2O + 5H2O 4 1 восстановление
4Zn + 10HNO3 = 4Zn(NO3)2 + N2O + 5H2O.
Суммарный процесс представим в виде окислительно-восстановительной и обменной составляющей:
1) 4Zn + 2HNO3 → 4ZnO + N2O + H2O окисление-восстановление
2) 4ZnО + 8HNO3 → 4Zn(NO3)2 + 4H2O обмен
В окислительно-восстановительном процессе число эквивалентности цинка равно двум, так как один атом цинка отдает два электрона. Одна молекула азотной кислоты принимает четыре электрона, поэтому число эквивалентности на этой стадии тоже равно четырем. В обменном процессе число эквивалентности оксида цинка тоже равно двум, а азотной кислоты единице (один протон в молекуле), но во второй стадии участвует оксид цинка, образовавшийся в первой, и дополнительно восемь молекул азотной кислоты, поэтому для общей реакции эквивалентное число для цинка равно их сумме в обеих стадиях (2 + 2 = 4), а для азотной кислоты равно четырем для окислительно-восстановительной стадии и единице для обменной.