ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Электрохимические методы анализа основаны на изучении и использовании окислительно-восстановительных процессов, протекающих на поверхности электрода или в приэлектродном слое раствора электролита.
Любой электрический параметр (потенциал, сила тока, сопротивление и др.), функционально связанный с концентрацией определяемого компонента и поддающийся правильному измерению, может служить аналитическим сигналом.
Чувствительные элементы небольших размеров, генерирующие аналитический сигнал, интенсивность которого зависит от концентрации определяемого вещества, называются сенсорами.
Сенсор – это первичное устройство, регистрирующее (откликающееся) на определенные свойства окружающей среды и позволяющее регистрировать этот отклик в виде соответствующего электрического (оптического и др.) сигнала.
Физические сенсоры определяют такие свойства, как температура, давление и пр.
Химические сенсоры дают информацию о присутствии и концентрации различных веществ в этих средах.
В биосенсорах реализуются реакции: антитело – антиген, фермент – субстрат, рецептор – гормон.
Например, для определения концентрации углекислого газа используются кондуктометрические сенсоры, основанные на измерении электрической проводимости водного раствора диоксида углерода. Увеличение электропродности анализируемого раствора (за счет наличия в нем ионов Н+ и НСО32-) по сравнению с холостым (без СО2) является аналитическим сигналом.
Различают прямые и косвенные электрохимические методы. В прямых методах используют зависимость величины измеряемого параметра от концентрации измеряемого компонента. В косвенных методах силу тока (потенциал, сопротивление и т.д.) измеряют с целью нахождения конечной точки титрования определяемого компонента подходящим титрантом, т.е. используют зависимость измеряемого параметра от объема титранта.
Для любого рода электрохимических измерений необходима электрохимическая цепь или электрохимическая ячейка, составной частью которой является анализируемый раствор. Ячейка состоит из пары электродов, погруженных в раствор электролита. Это устройство позволяет пространственно разделить процессы окисления и восстановления. В этом случае перенос электронов от восстановителя к окислителю осуществляется с помощью пары электродов и проводников во внешней цепи. непосредственный контакт окислителя и восстановителя устраняют, помещая их в отдельные сосуды. Если соединить электроды внешним проводником, а растворы солевым мостиком, то электроны, полученные одним электродом от восстановителя, перейдут по внешнему проводнику ко второму электроду и будут отданы окислителю. В результате на поверхности одного из электродов будет протекать реакция окисления (анод), а на другом восстановления (катод). Во внешней цепи потечет электрический ток.
Электрохимические ячейки бывают двух типов: гальванические элементы и электролитические ячейки (электролизеры). В гальваническом элементе химические реакции протекают самопроизвольно на границе раздела электрод/электролит, а электроды соединены друг с другом проводником. Несколько гальванических элементов, соединенных последовательно, образуют батарею – химический источник тока. В электролитической ячейке реакции на границе раздела электрод/электролит протекают за счет внешнего источника электрической энергии; последняя превращается в химическую энергию продуктов реакций, протекающих на электродах. Устройство гальванического элемента представлено на рис. 1, а электролизера – на рис. 2. Отметим, что одна и та же ячейка в зависимости от режима работы может вести себя то как гальванический элемент, то как электролизер. Так, автомобильный свинцовый аккумулятор действует как гальванический элемент, когда используется для запуска двигателя (при этом он разряжается), и как электролизер, когда заряжается от автомобильного генератора или от зарядного устройства.
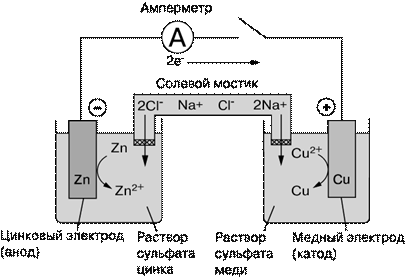 Рис. 1
Рис. 1
Простой гальванический элемент, созданный в 1836 Дж.Даниелем (рис. 1), состоит из двух электродов: цинкового, погруженного в водный раствор сульфата цинка, и медного, погруженного в водный раствор сульфата меди (II). Такой элемент аналогичен медно-цинковым пáрам в вольтовом столбе. При замкнутой внешней цепи атомы цинка на поверхности цинкового электрода окисляются до ионов с высвобождением электронов: Zn → Zn2+ + 2e– . Эти электроны перемещаются по внешней цепи на медный электрод и восстанавливают ионы меди до атомов: Cu2+ + 2e– → Cu. Поток электронов во внешней цепи – это и есть ток, вырабатываемый элементом. Суммарная реакция, приводящая к химическому превращению и к генерации электрической энергии, имеет вид:
Cu2+ + Zn → Cu + Zn2+
Точно такая же реакция протекает при добавлении металлического цинка в раствор сульфата меди, но в этом случае химическая энергия переходит в тепловую.
Электрохимические ячейки часто представляют схематически, обозначая границу между электродом и электролитом вертикальной или косой чертой (| или /), а солевой мостик – двумя косыми черточками (//). Так, гальваническому элементу на рис. 1 отвечает запись:
Zn / Zn2+ (1М)// Cu2+ (1М)/ Cu
где M – молярная концентрация раствора В электролитической ячейке, изображенной на рис. 2, протекают те же реакции, что и в промышленных электролизерах для получения хлора и щелочи: превращение рассола (концентрированного водного раствора хлорида натрия) в хлор и гидроксид натрия NaOH:
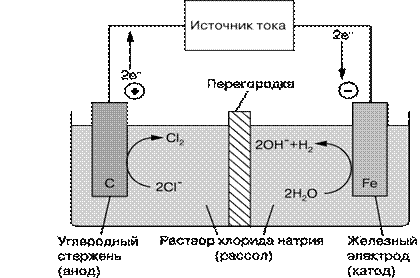 Рис. 2
Рис. 2
2Cl- + 2H2O → Cl2 + H2 + 2OH-
Хлорид-ионы на графитовом электроде окисляются до газообразного хлора, а вода на железном электроде восстанавливается до водорода и гидроксид-иона. Электролиты остаются электронейтральными благодаря перемещению ионов натрия через перегородку – ионообменную мембрану. Электрод, на котором осуществляется окисление (цинк на рис. 1 и графит на рис. 2), называется анодом, а электрод, на котором происходит восстановление, – катодом. На катоде протекает реакция: · 2Н2О + 2е- = Н2 + 2ОН- При этом происходит накопление отрицательного заряда в растворе за счет образования гидроксид-анионов (ОН-). Для нейтрализации заряда через полупроницаемую перегородку из прианодного раствора поступают катионы натрия (Na+) и формируют NaОН. На аноде протекает реакция:
2Cl- + 2е- → Cl2
При этом в растворе нарушается равновесие количества отрицательного (Cl-) и положительного заряда (Na+), так как уменьшается количество хлорид-анионов. Поэтому начинается перемещение избытка катионов натрия из прианодного раствора к катодному. У катода образуется щелочной раствор, а у анода уменьшается концентрация NaCl (вода опресняется). Один из электродов должен обратимо реагировать на изменение состава анализируемого раствора, чтобы по наличию (или отсутствию) аналитического сигнала и его интенсивности можно было судить о том, есть ли интересующий нас компонент в растворе и сколько его. Этот электрод, являющийся как бы зондом называют индикаторным. Индикаторный электрод не должен реагировать с компонентами ратвора, поэтому для их изготовления применяют химически инертные токопроводящие материалы: благородные металлы (золото, платина, ртуть), углеродные материалы (графит, стеклоуглерод). Бывают мембранные (ионселективные) и металлические индикаторные электроды. Возникновение потенциала мембранного электрода обусловлено ионообменными процессами на границе раздела электрод - раствор, потенциал металлического электрода определяется электронообменными процессами на межфазной границе. Потенциал ионселективного электрода линейно зависит от логарифма активности (lga) определяемого иона в растворе. Потенциал металлического электрода - от логарифма активности собственных ионов в растворе. Для анализа много компонентных смесей используют мультисенсорные системы, т.е. в один раствор опускается несколько мембранных электродов, каждый из которых подает сигнал на наличие определенного вещества в смеси. Второй электрод - это электрод сравнения. Он обладает постоянным, не зависящим от состава раствора потенциалом. В качестве электродов сравнения используют хлоридсеребрянный и каломельный электроды. Хлоридсеребрянный электрод состоит из серебрянной проволочки покрытой слоем хлорида серебра и погруженной в раствор хлорида калия, насыщенный хлоридом серебра.
Потенциал такого электрода равен:
Е(Ag+/AgCl) = Е°(Ag+/Ag) + 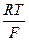 ln[Ag+] = Е°(Ag+/Ag) +
ln[Ag+] = Е°(Ag+/Ag) + 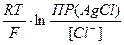 = Е°(Ag+/Ag) +
= Е°(Ag+/Ag) + 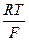 . lnПР -
. lnПР - 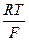 . ln[Сl-]
. ln[Сl-]
Каломельный электрод состоит из металлической ртути, каломели (Hg2Cl2) и раствора KCl.
Потенциал электрода равен:
Е(Hg22+/Hg2Cl2) = Е0(Hg22+/Hg) + 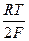 ln ПР(Hg2Cl2) -
ln ПР(Hg2Cl2) - 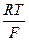 ln[Cl-]
ln[Cl-]