Решение типовых задач
1. Элемент состоит из водородного электрода, опущенного в кровь
и каломельного электрода насыщенного раствором KCl, потенциал которо-
го равен 0,25В. Определить рН и [Н+] крови при 18оС, если э.д.с. эле-
мента равна 0,677В.
Решение: э.д.с. элемента равно разности электродных потенциалов катода и анода. В данном случае это разность потенциалов электода сравнения и ионоселективного (стеклянного) : э.д.с. =Есравнения - Е(Н+) ; находим Е(Н+) = Есравнения - э.д.с. =0,25 - 0,677 = -0,427В;
Известно, что потенциал водородного электрода зависит от концентрации протонов в растворе, а значит от рН: Е(Н+) = - 0,059рН, тогда рН = - Е(Н+)/0,059 = 0,427/0,059 = 7,24 = -lg[H+], откуда [H+] = 10-pH = 10-7,24 =
0,57 . 10-7 моль/л.
Ответ: рН=7,24; концентрация ионов водорода [H+] = 0,57 . 10-7 моль/л.
2. Вычислить ЭДС гальванического элемента:
Zn|0,1 моль/л Zn(NO3)2; 1,4 моль/л NH3|| 1M KCl, AgCl| Ag
Решение:
Zn = Zn2+ + 2e-; Е°(Zn2+/Zn) = -0,764 B
Ag+ + e- = Ag; Е°(Ag+/Ag) = 0,7994 B
Окислительно-восстановительные потенциалы электродов вычислим по уравнениям (Нернста):
Е(Zn2+/Zn) = Е°(Zn2+/Zn) + (0,059/2) . lg[Zn2+]; n=2
Е(Ag+/Ag) = Е°(Ag+/Ag) + 0,059lg[Ag+]; n=1.
При избытке аммиака протекает процесс комплексообразования, характеризующийся константой устойчивости
Zn(NH3)4]2+ b= 109 . Обозначим за х равновесную концентрацию ионов цинка, оставшегося в растворе после образования комплекса. Тогда для процесса его образования:
0,1-x 4(0,1-x) (к-во NH3 и Zn2+ в комплексе)
Zn2+ + 4NH3 = [Zn(NH3)4]2+
x 1,4 - 4(0,1 - x) 0,1 - x (равновесные концентрации веществ).
Так как х<< 0,1, то величиной х можно пренебречь, и тогда (0,1-х) = 0,1. Так как b = [Zn(NH3)42+] /[Zn2+][NH3]4, концентрация ионов цинка будет равна:
х =[Zn2+] = [Zn(NH3)4]2+/b.[NH3]4 = 10-4 моль/л.
Подставляем эту величину в выражение для потенциала:
Е(Zn2+/Zn) = Е°(Zn2+/Zn) + (0,059/2) . lg[Zn2+] = -0,764 + 0,059/2 lg 10-10 =
- 1,059 B.
Рассчитаем потенциал серебрянного электрода. Равновесная концентрация серебра будет незначительной, так как присутствие ионов хлора приводит к образованию осадка AgCl. Находим ее как растворимость хлорида серебра в 1М растворе KCl, используя формулу связывающую произведение растворимости соли с концентрациями ионов ее составляющих: ПР(AgCl) = [Ag+] . [Cl-] = 1,78 . 10-10, отсюда:
[Ag+] =ПР(AgCl) /[Cl-] = 1,78 . 10-10 . 1, так как концентрация ионов хлора равна концентрации хлорида калия и равна единице (незначительным количеством ионов хлора в растворе от AgCl можно пренебречь).
Е(Ag+/AgСl) = Е°(Ag+/Ag) + 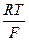 ln[Ag+] = Е°(Ag+/Ag) +
ln[Ag+] = Е°(Ag+/Ag) + 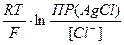 = Е°(Ag+/Ag) +
= Е°(Ag+/Ag) + 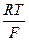 . lnПР -
. lnПР - 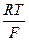 . ln[Сl-].
. ln[Сl-].
В стандатных условиях Е°(Ag+/Ag) + 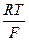 . lnПР(AgCl) = Е°(Ag+/Ag) + 0,059 . lgПР(AgCl) = E0(Ag+/AgCl).
. lnПР(AgCl) = Е°(Ag+/Ag) + 0,059 . lgПР(AgCl) = E0(Ag+/AgCl).
Так как молярная концентрация ионов хлора равна единице, то lg[Сl-] будет равен нулю и потенциал хлорсеребряного электрода будет соответствовать стандартному:
E(Ag+/AgCl) = E0(Ag+/AgCl) = Е°(Ag+/Ag) + 0,059 . lg[Ag+] = 0,7994 + 0,059 . lg (1,78 . 10-10)= 0,224 B. Потенциал цинкового электрода (-1,059 В) меньше, чем серебряного (0,224 В), значит он является анодом.
Э.Д.С. гальванического элемента рассчитаем как разность окислительно- восстановительных потенциалов катода и анода:
ЭДС = 0,224 -(-1,059) = 1,283 В. Потенциал
3. Рассчитать потенциал водородного электрода 0,1М раствора нитрита натрия NaNO2. КД(HNO2) = 4 . 10-4.
Решение.
В соответствии с уравнением Нернста потенциал водородного электрода определяется концентрацией протонов в растворе, а значит и рН: Е(Н+) = - 0,059рН, поэтому величину водородного показателя необходимо рассчитать. Нитрит натрия – соль, образованная слабой кислотой и сильным основанием и в растворе будет подвергаться гидролизу по аниону: NO2- + HOH = HNO2 + OH-. рОН такого раствора вычисляется по формуле: рОН =  = -½ (lgКводы + lgСсоли - lgКД) . рН = 14 – рОН = 14 - (
= -½ (lgКводы + lgСсоли - lgКД) . рН = 14 – рОН = 14 - ( ) = 7 + ½рКД + ½ lgCсоли = 7 + 1,7 – 0,5 = 8,2. Подставляем в выражение для потенциала и получаем: Е(Н+) = - 0,059рН = - 0,48 В.
) = 7 + ½рКД + ½ lgCсоли = 7 + 1,7 – 0,5 = 8,2. Подставляем в выражение для потенциала и получаем: Е(Н+) = - 0,059рН = - 0,48 В.