Люминесценция
Поглотив квант энергии электромагнитного излучения частица вещества переходит из основного, самого нижнего по энергии (S0) электронного состояния, в более высокое по энергии возбужденное (S1, S2….Si…S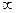 ) состояние, в котором частица может находиться ~ 10-8 – 10-13 сек. Совокупность процессов преобразования энергии в молекуле называется фотофизическими процессами. Для молекулы органического соединения основное состояние обычно синглетное (S0), которое означает, что количество электронов в молекуле с противоположными спинами одинаково и их суммарный спин равен нулю (на каждой молекулярной орбитали находится по два электрона с противоположно направленными спинами
) состояние, в котором частица может находиться ~ 10-8 – 10-13 сек. Совокупность процессов преобразования энергии в молекуле называется фотофизическими процессами. Для молекулы органического соединения основное состояние обычно синглетное (S0), которое означает, что количество электронов в молекуле с противоположными спинами одинаково и их суммарный спин равен нулю (на каждой молекулярной орбитали находится по два электрона с противоположно направленными спинами  . Из возбужденного квантового состояния (обычно синглетного Si,
. Из возбужденного квантового состояния (обычно синглетного Si,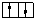 ) происходит либо излучение (люминесценция), либо безызлучательное перераспределение энергии среди всех частиц системы в тепловую (безызлучательная релаксация). Система приходит в состояние равновесия, характеризуемого определенной температурой (Рис.8). Можно выделить два этапа этого процесса. Вначале протекает изоэнергетический (без потери молекулой энергии) «горизонтальный» из одного квантового состояния в другое. Эти безызлучательные переходы бывают двух типов: без изменения спина электрона – внутренняя конверсия( ВК, Sn
) происходит либо излучение (люминесценция), либо безызлучательное перераспределение энергии среди всех частиц системы в тепловую (безызлучательная релаксация). Система приходит в состояние равновесия, характеризуемого определенной температурой (Рис.8). Можно выделить два этапа этого процесса. Вначале протекает изоэнергетический (без потери молекулой энергии) «горизонтальный» из одного квантового состояния в другое. Эти безызлучательные переходы бывают двух типов: без изменения спина электрона – внутренняя конверсия( ВК, Sn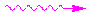 Si , Tn
Si , Tn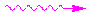 Ti ) и с обращением спина – интеркомбинационная конверсия (ИК, Sn
Ti ) и с обращением спина – интеркомбинационная конверсия (ИК, Sn  Ti и Tn
Ti и Tn  Si ). Символом Ti обозначается триплетное состояние (обычно возбужденное), которое означает, что на двух высших по энергии занятых орбиталях молекулы находится по одному электрону с одинаково направленными спинами (
Si ). Символом Ti обозначается триплетное состояние (обычно возбужденное), которое означает, что на двух высших по энергии занятых орбиталях молекулы находится по одному электрону с одинаково направленными спинами ( ) и суммарный спин электронов отличен от нуля (равен единице). У Ti триплетного состояния уровень энергии ниже энергии одинакового с ним по орбитальной природе и отличающегося только спином синглетного Si состояния. Второй этап – это либо безызлучательный быстрый «вертикальный» переход с высокого колебательного уровня нового электронного состояния на более низкие колебательные с передачей избытка колебательной энергии другим молекулам системы (колебательная релаксация), либо излучательный. Люминесценция также бывает двух типов: переходы без изменения спина электрона - флуоресценция (Sn
) и суммарный спин электронов отличен от нуля (равен единице). У Ti триплетного состояния уровень энергии ниже энергии одинакового с ним по орбитальной природе и отличающегося только спином синглетного Si состояния. Второй этап – это либо безызлучательный быстрый «вертикальный» переход с высокого колебательного уровня нового электронного состояния на более низкие колебательные с передачей избытка колебательной энергии другим молекулам системы (колебательная релаксация), либо излучательный. Люминесценция также бывает двух типов: переходы без изменения спина электрона - флуоресценция (Sn Si и Tn
Si и Tn  Ti) и с изменением - фосфоресценция (Tn
Ti) и с изменением - фосфоресценция (Tn  Si и Si
Si и Si Tк). На практике обычно наблюдаются не все из указанных фотофизических процессов, так как вероятность их реализации разная и отличается иногда на много порядков. Так, у нежестких органических молекул наблюдается безызлучательная релаксация энергии электронного возбуждения и отсутствие флуоресценции и фосфоресценции. Весьма незначительна вероятность не указанных на схеме (Рис. 8) излучательных переходов Tn
Tк). На практике обычно наблюдаются не все из указанных фотофизических процессов, так как вероятность их реализации разная и отличается иногда на много порядков. Так, у нежестких органических молекул наблюдается безызлучательная релаксация энергии электронного возбуждения и отсутствие флуоресценции и фосфоресценции. Весьма незначительна вероятность не указанных на схеме (Рис. 8) излучательных переходов Tn  Ti и Si
Ti и Si Tк, а также со второго и более высоких возбужденных состояний молекул в основное. Наблюдаются обычно указанные на схеме более вероятные излучательные переходы из первого возбужденного синглетного (S1
Tк, а также со второго и более высоких возбужденных состояний молекул в основное. Наблюдаются обычно указанные на схеме более вероятные излучательные переходы из первого возбужденного синглетного (S1 S0, флуоресценция) и первого возбужденного триплетного (T1
S0, флуоресценция) и первого возбужденного триплетного (T1  S0, фосфоресценция) состояния в основное. Путь, по которому молекула переходит из возбужденного в основное состояния, определяется типом перехода, структурой молекулы и средой, в которой она находится. Так, переходы с изменением спина электрона менее вероятны, чем без изменения (запрет по спину).
S0, фосфоресценция) состояния в основное. Путь, по которому молекула переходит из возбужденного в основное состояния, определяется типом перехода, структурой молекулы и средой, в которой она находится. Так, переходы с изменением спина электрона менее вероятны, чем без изменения (запрет по спину).
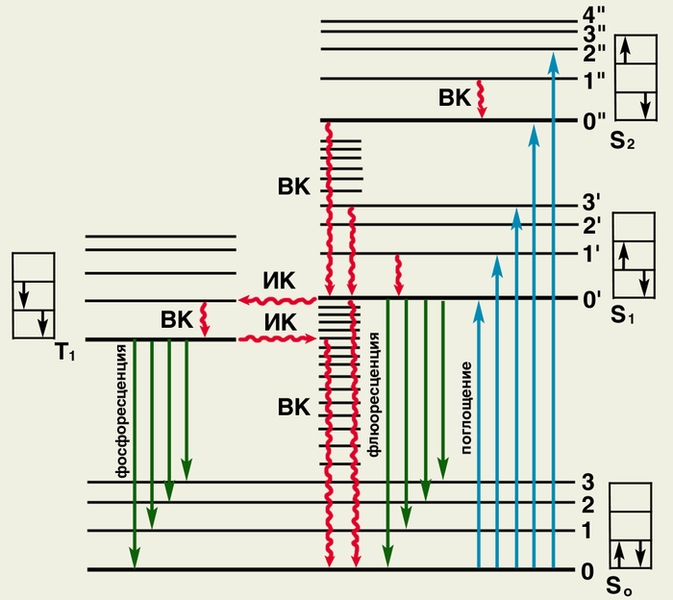
Рис. 8. Схематическое изображение физического механизма люминесценции: жирными черными горизонтальными линиями обозначены энергетические состояния молекулы люминесцирующего вещества; S0 — основное (невозбужденное) состояние; S2, S2 и Т1 — возбужденные состояния; тонкими горизонтальными линиями обозначены колебательные уровни (0, 1, 2.,. или 0| , 1|, 2| и т.д.); в прямоугольниках стрелками показано направление спина возбужденного электрона (слева) по отношению к спину оставшегося электрона; ВК — внутренняя конверсия (переходы электрона без обращения спина); ИК — интеркомбинационная конверсия (переходы электрона с обращением спина). При поглощении энергии молекула переходит в возбужденное состояние S1 или S2 (обозначено синими вертикальными стрелками  ). Часть поглощенной энергии преобразуется в тепло (обозначено волнистыми стрелками
). Часть поглощенной энергии преобразуется в тепло (обозначено волнистыми стрелками  ), при этом молекула переходит из состояний (S2, 1||), (S2, 2||) вначале на (S2,0||), а затем по колебательным уровням (S0, n, n-1… и т.д.) «спускается» на нижний колебательный уровень состояния (S1, 0|) или трансформируется в состояние Т1. Возвращение молекулы из состояния S1 или Т1 на исходный энергетический уровень S0 может сопровождаться излучением света — флюоресценцией или фосфоресценцией (обозначены зелеными стрелками
), при этом молекула переходит из состояний (S2, 1||), (S2, 2||) вначале на (S2,0||), а затем по колебательным уровням (S0, n, n-1… и т.д.) «спускается» на нижний колебательный уровень состояния (S1, 0|) или трансформируется в состояние Т1. Возвращение молекулы из состояния S1 или Т1 на исходный энергетический уровень S0 может сопровождаться излучением света — флюоресценцией или фосфоресценцией (обозначены зелеными стрелками  ).
).
Разность в энергии уровней Sn - Sn-1 или Тn- Тn-1уменьшается с ростом номера уровня n (для атомов - главного квантового числа) и после второго возбужденного они по существу сливаются.
В люминесцентной спектроскопии измеряется интенсивность излучения, испускаемого атомами или молекулами вещества при их переходе из возбужденного состояния в основное. Способность системы люминесцировать характеризуется квантовым выходом люминесценции φ, который равен отношению числа излученных фотонов Nизлученных к числу поглощенных Nпоглощенных возбуждающего люминесценцию электромагнитного излучения:
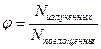 . Очевидно, что 0 < φ < 1
. Очевидно, что 0 < φ < 1
и энергия излученного фотона Еизлученного = hνиз= hc/λиз меньше энергии поглощенного Епоглощенного = hνпо = hc/λпо, а длина волны излучения больше длины волны поглощения (λиз > λпо).
Люминесценция бывает двух типов: флуоресценция и фосфоресценция. При флуоресценции атом или молекула переходит в основное состояние из короткоживущего возбужденного состояния. Она наблюдается почти сразу после поглощения, быстро спадает и исчезает в результате столкновений излучающей молекулы с другими молекулами в растворе (тушение флуоресценции). Фосфоресценция наблюдается при переходе молекулы в основное состояние из относительно долгоживущего возбужденного состояния, так что между поглощением света и испусканием может пройти относительно много времени. Для фосфоресценции характерны бóльшая длина волны излучения, меньшая высота пиков и большее влияние матрицы. Флуоресцентные измерения более избирательны, чем спектрофотометрические, поскольку зависят сразу от двух длин волн: поглощаемого и испускаемого света.
Интенсивность флуоресценции связана с интенсивностью поглощенного света следующим соотношением: Iисп = kIпогл. Это соотношение линейно относительно концентрации только при малых ее значениях: Iисп = kўIпоглC. Здесь k и kў – константы, характеризующие свойства молекулы, связанные с поглощением и испусканием излучения, а C – концентрация определяемого вещества. Флуоресцентный анализ позволяет измерять в 1000 раз меньшие концентрации, чем спектрофотометрический. Это связано с характером сигнала, определяемого в том и другом случаях: во флуоресцентных измерениях нужно зарегистрировать небольшую разницу между двумя слабыми сигналами, а при измерениях поглощения – между сильными, что гораздо сложнее.
Если свет испускается в результате химической реакции, то процесс называют хемилюминесценцией. Интенсивность излучения зависит от скорости химической реакции, а последняя, в свою очередь, от концентрации. Таким образом, измеряя интенсивность хемилюминесценции, можно определить концентрацию соответствующего реагента. В качестве примера люминесцентного определения приведем реакцию с участием люминола. При окислении пероксидом водорода в присутствии комплексов переходных металлов это вещество люминесцирует, что позволяет проводить количественное определение следовых количеств ионов металлов (или некоторых комплексов), а также пероксида водорода.