Дополнение
Основные математические формулы, знание которых необходимо для решения задач по аналитической химии:
рХ = -lgX, при этом Х = 10-рХ = 10lgX; логарифм числа 10n равен n т.е. lg10n = n; логарифм произведения чисел равен сумме логарифмов этих чисел: lg(A . B) = lgA + lgB; корень степени m числа 10n равен 10n/m, например, логарифм корня в степени m числа 10n равен lg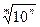 = lg10n/m =
= lg10n/m = 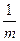 lg10n = n/m.
lg10n = n/m.  Так, логарифм корня квадратного 10-6 равен -6/2 =-3, например: 0,5. lg102 =
Так, логарифм корня квадратного 10-6 равен -6/2 =-3, например: 0,5. lg102 =  lg102 = lg
lg102 = lg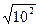 = lg101 =1.
= lg101 =1.
Х-n = 1/Xn; 1/X = X-1, например:
10-1 = 1/101= 0,1; 10-3 = 1/103 = 0,001 и.т.д. 102 = 10 . 10 =100; 103 = 10 . 10 . 10 = 1000 и.т.д.
Логарифм единицы по любому основанию равен нулю: loga1 = 0; lg1 = 0.
Любое число в нулевой степени равно единице: X0 = 1; 100 = 1.
При замене натурального логарифма на десятичный необходимо помнить, что lnN =lgN/lge = 2,3. lgN, так как 1/lge = 2,3; где e = 2,71828…. При замене десятичного логарифма натуральным необходимо помнить, что lgN = lnN/ln10 =
0,434. lnN, так как 1/ln10 = 0,434.
Решениями (корнями) квадратного уравнения ах2 + bх + c =0 будут:
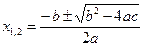 .
.
Фундаментальные физико-химические константы:
скорость света в вакууме (с) – 299792458 м/с,
постоянная Планка (h) – 6,6260693 . 10-34 Дж . с,
элементарный заряд (е) – 1,602177 . 10-19 Кл,
постоянная Авогадро (NA) – 6,0221415 . 1023 моль-1,
универсальная молярная газовая постоянная (R) – 8,314472 Дж . моль-1 . К-1, 0,082057 л . атм . моль-1 . град-1, 6236367 мл . мм. рт.ст. . моль-1 . град-1, 1,987207 кал . моль-1 . град-1,
атомная единица массы (а.е.м. – mu) – 1,66053886 . 10-27 кг,
объем одного моля идеального газа при нормальных условиях (н.у. – Т = 273,150К, Р = 1атм = 101325 Па) (VM) – 22,413995 . 10-3м3 . моль-1 = 22,413995 л . моль-1
Константа равновесия любого обратимого процесса равна отношению произведений молярных концентраций в степенях равных стехиометрическим коэффициентам в уравнении, соответствующем данному процессу, продуктов процесса к произведению аналогичных величин исходных веществ или ионов. Например, для равновесного процесса: n1А + n2B ↔ n3C + n4D
Кравн. = 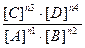 Для равновесия осадок - раствор Кравн. - это произведение растворимости соли (ПР), для диссоциации слабых кислот и оснований - Кдисс., для образования комплексного иона - константа устойчивости комплексного иона (b) и.т.д.
Для равновесия осадок - раствор Кравн. - это произведение растворимости соли (ПР), для диссоциации слабых кислот и оснований - Кдисс., для образования комплексного иона - константа устойчивости комплексного иона (b) и.т.д.
При решении задач в сумме и разности малыми величинами можно пренебречь. В случае умножения или деления малыми величинами пренебрегать нельзя. Например, 100000 +1 = 100001 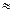 100000. Относительная ошибка в этом случае составит 0,001%. В случае 1000 . 0,001 = 1 величиной 0,001 нельзя пренебречь, так как ответ будет в 1000 раз больше. Ошибка в этом случае составит 100000%. Приближенными расчетами приходится пользоваться при решении задач, в которых необходимо рассчитать равновесную концентрацию иона, образующего осадок, слабо диссоциирующий электролит (кислоты и основания) или комплексное соединение с присутствующими в избытке ионами противоположного знака или нейтральными лигандами.
100000. Относительная ошибка в этом случае составит 0,001%. В случае 1000 . 0,001 = 1 величиной 0,001 нельзя пренебречь, так как ответ будет в 1000 раз больше. Ошибка в этом случае составит 100000%. Приближенными расчетами приходится пользоваться при решении задач, в которых необходимо рассчитать равновесную концентрацию иона, образующего осадок, слабо диссоциирующий электролит (кислоты и основания) или комплексное соединение с присутствующими в избытке ионами противоположного знака или нейтральными лигандами.
Последовательность решения задач.
1. Написать уравнения всех реакций и процессов (химических реакций, диссоциации или гидролиза электролитов, образования комплексов или осадка).
2. Написать выражения констант равновесия через концентрации веществ и ионов указанных процессов (произведение растворимости, константы диссоциации или гидролиза, константы устойчивости комплексов), которые являются математическими уравнениями для нахождения концентрации определяемого компонента.
3. В соответствии со стехиометрическими законами, на основании уравнений (пункт1) высчитываем количества (концентрации) всех компонентов, входящих в выражение констант в состоянии равновесия, обозначив концентрацию определяемого компонента через х.
4. Решаем уравнение (или несколько уравнений, если определяемое вещество участвует в нескольких процессах) относительно х.
5. Высчитываем значение параметра, зависящего от концентрации определяемого компонента (электродный потенциал, рН и.т.д).
| Таблица основных математических формул методов аналитической химии | |||
| Закон эквивалентов для растворов реагирующих веществ | Сэкв. (А1 ) . V(А1) = Сэкв. (А2 ) . V(А2) = … Сэкв. (Аi ) . V(Аi), где Сэкв. – нормальная концентрация вещества в растворе, V – объем раствора | ||
| Способы выражения концентрации растворов | |||
| Молярная концентрация | СМ = 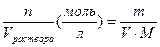
| ||
| Молярная концентрация эквивалента (нормальная концентрация) | Cэкв. = 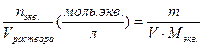
| ||
| Массовая доля | w(X) = m (X)/m(раствора) | ||
| Титр раствора | Т = 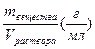
| ||
| Молярная доля вещества | χ (Аi) =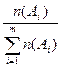 ; процентах: χ (Аi) = ; процентах: χ (Аi) = 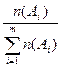 .100% .100%
| ||
| Связь различных способов выражения концентрации растворов | |||
| Молярность - массовая доля (СМ - ω) | СМ = 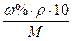
| ||
| Моляльность – массовая доля (Cm – ω) | Cm = ω.1000/M(1 – ω) = 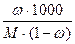 В случае процентного выражения массовой доли:
Cm = ω%.1000/M(100 – ω%) = В случае процентного выражения массовой доли:
Cm = ω%.1000/M(100 – ω%) = 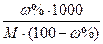
| ||
| Молярность – нормальность (СМ– Сэкв.) | Cэкв. = Z.CM | ||
| Ионная сила и рН растворов | |||
| Ионная сила растворов | μ = 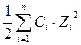
| ||
| рН и рОН растворов | рН = -lg[H+], рОН = -lg[ОH-] | ||
| Расчет рН растворов разных электролитов | |||
| Сильной кислоты | pH = -lg[H+] = -lgСн, где Сн или Сэк., СN –нормальная концентрация кислоты. | ||
| Сильного основания | рН = 14 + lg[OH-] = 14 + lgСo, где Сo или Сэк., СN – нормальная концентрация основания | ||
| слабой кислоты | рН= 0,5 рКк – 0,5 lgCк = -lg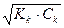 = 0,5 рКк + 0,5 pCk = = 0,5 рКк + 0,5 pCk =  рКк + рКк +  рСк, где Cк - молярная концентрация слабой кислоты, pCк = -lgCк рСк, где Cк - молярная концентрация слабой кислоты, pCк = -lgCк
| ||
| cлабого основания | 7) рН = 14 – рОН = 14 – (-lg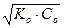 ), так как рОН = -lg ), так как рОН = -lg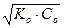
| ||
| Гидролиз соли слабой кислоты и сильного основания | pH = 7 + 0,5 pKк + 0,5 . lgCсоли = 14 – рОН = 14 + lg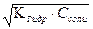
| ||
| Гидролиз соли сильной кислоты и слабого основания | pH = 7 – 0,5 pKосн. – 0,5 . lgCсоли = -lg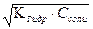
| ||
| Кислой буферной смеси | рН= -lg[H+] =-lg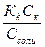 = -lgKk – lg(Ck/Cсоли) = рКк – lg(Ck/Cсоли) = рКк – lgCk + lgСсоли. = -lgKk – lg(Ck/Cсоли) = рКк – lg(Ck/Cсоли) = рКк – lgCk + lgСсоли.
| ||
| Основной буферной смеси | рН = 14 + lg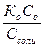 = 14 – рКо + lgCo/Ccоли = 14 – рКо + lgCo – lgCcоли = 14 – рКо + lgCo/Ccоли = 14 – рКо + lgCo – lgCcоли
| ||
| ГРАВИМЕТРИЧЕСКИЙ (ВЕСОВОЙ) МЕТОД АНАЛИЗА | |||
| Произведение растворимости | ПР (АmBn) = [A]m · [B]n | ||
| Масса определяемого компонента в пробе | m(A) = mгр · fгр , где fгр –гравиметрический фактор, mгр – масса гравиметрической формы | ||
| ТИТРИМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА | |||
| Концентрация определяемого в методе прямого титрования | CВ = CТ . VТ/VВ | ||
| Концентрация определяемого в методе обратного титрования | Сэкв.(В) = (CТ1 . VТ1 – CТ2 . VТ2)/СВ | ||
| Концентрация определяемого в методе титрования по замещению | CВ = CТ2 . VТ2/VВ | ||
| рН в точке эквивалентности метода кислотно-основного титрования | pHт.э. = 7 – при титровании сильной кислоты и сильного основания
pHт.э. = 7 + 0,5 pKк + 0,5 . lgCсоли = 14 – рОН = 14 + lg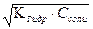 - при титровании слабой кислоты
pHт.э. = 7 – 0,5 pKосн. – 0,5 . lgCсоли = -lg - при титровании слабой кислоты
pHт.э. = 7 – 0,5 pKосн. – 0,5 . lgCсоли = -lg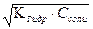 - при титровании слабого основания - при титровании слабого основания
| ||
| Окислительно-восстановительное титрование | |||
| Уравнение Нернста | Е = Е0 + (0,059/n1) . lg ([Ox]/[Red]) | ||
| Потенциал в точке эквивалентности | Е =(n1 . E01 + n2 . E02)/(n1 + n2), где E01 и E02 – стандартные электродные потенциалы пар окислителя и восстановителя реакции титрования, а n1 и n2 – число электронов в полуреакциях | ||
| Комплексонометрия | |||
| рМе в точке эквивалентности | 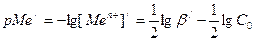 = =  где С0 – первоначальная концентрация иона металла; где С0 – первоначальная концентрация иона металла;
| ||
| Интервал перехода индикаторов | |||
| Метод нейтрализации | рН1,2 = рК±1 НХ ↔ Н+ + Х- рОН1,2 = рК±1 МОН ↔ М+ + ОН- | ||
| Редокс титрование | Е1,2 = Е0 ± 0,059/n Ox + ne- ↔ Red | ||
| Комплексонометрия | pMe1,2 = [-lg([H+]/KHind) + lgβMeInd] ± 1 (эриохромчерный) Меn+ + mL ↔ [MeLm]n+ | ||
| Физико-химические методы анализа | |||
| Потенциал электрода металл-раствор соли металла | Е = Е0 + 0,059/n ∙ lg [Men+] | ||
| Потенциал водородного электрода | ЕН+/Н2 = -0,059рН | ||
| Уравнение Лэнгмюра (изотерма адсорбции) | n = n∞∙ bc/(1+bc) | ||
| Закон Бугера-Ламберта-Бера | А = ε·ℓ·СM, где ε – молярный коэффициент поглощения, ℓ - толщина светопоглощающего слоя (кюветы), СМ – молярная концентрация раствора, А – оптическая плотность равная: А = -lgT = -lg(I/I0) =lg(I0/I), где I и I0 – соответственно интенсивности света, прошедшего через раствор и растворитель | ||
| Связь длины волны и частоты электромагнитного излучения | λ = с/ν ,где λ – длина волны, с – скорость света, ν – частота излучения | ||