Ионная сила и рН растворов
Большинство аналитических определений осуществляется в растворах, поэтому необходимо знать их основные свойства. Важным свойством раствора является его ионная сила, которая определяется как полусумма прозведений молярных концентраций ионов присутствующих в растворе на квадрат их заряда: μ = 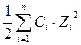 , где μ – ионная сила раствора, Сi – молярная концентрация данного иона, Zi – его заряд, n – общее количество ионов присутствующих в растворе.
, где μ – ионная сила раствора, Сi – молярная концентрация данного иона, Zi – его заряд, n – общее количество ионов присутствующих в растворе.
Величина ионной силы раствора определяет отличие эффективной (определяемой) (ai) концентрации иона, называемой активностью от истинной (ci). Связь истинной концентрации и активности осуществляется через коэффициент активности (fi): ai = fi .ci. Если концентрация электролитов в растворе незначительна (с < 10-4 моль/л), то ионная сила раствора невелика (μ ≈ 0) и электростатическое взаимодействие между противоионами незначительно, определяемая концентрация не отличается от истинной и коэффициент активности равен единице (f ≈1). Чем выше концентрация присутствующих в растворе электролитов, тем больше ионная сила раствора μ и тем значительнее отличие коэффициента активности от единицы (f < 1). Для определения коэффициента активности пользуются справочными таблицами зависимости его величины от ионной силы раствора. В общем случае коэффициент активности меньше или (при бесконечном разбавлении раствора) равен единице: f ≤ 1.
Можно рассчитать коэффициент активности по формулам Дебая-Хюккеля:
-lgfi = 0,5 . zi2 . 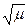 , если μ < 0,01;
, если μ < 0,01;
-lgfi = 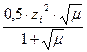 , если μ < 0,1.
, если μ < 0,1.
Следует иметь в виду, что при расчете концентраций (активностей) определяемых ионов с использованием констант равновесия, характеризующих различные обратимые процессы протекающие в растворах, необходимо использовать эффективные концентрации (активности) ионов. Такими константами являются константы диссоциации слабых электролитов, гидролиза солей, прозведения растворимости электролитов, выпадающих в осадок, нестойкости комплексных соединений. В уравнении Нернста расчет потенциала окислительно-восстановительных систем необходимо проводить с использованием активностей.
Удобным является в этой связи проведение анализа разбавленных растворов. При этом ионная сила раствора невелика, а значит, активность ионов незначительно отличается от концентрации и этим различием можно пренебречь.
Важной характеристикой протонных растворов, к которым, в частности, относятся и водные, является водородный показатель или рН среды. Водородный показатель – это отрицательный десятичный логарифм молярной концентрации ионов водорода, выраженной в моль/л: рН = -lg[H+]. Гидроксильный показатель – это отрицательный десятичный логарифм молярной концентрации гидроксильных ионов, выраженной в моль/л: рОН = -lg[ОH-]. С учетом эффективных концентраций (активностей) ионов водорода и гидроксила получим: раН = -lg([H+] . fH+ ) = -lg[H+] - lg fH+ = pH - lg fH+ , раОН = -lg([ОH-] . fHО- ) = -lg[ОH-] - lg fОH- = pОH - lg fОH-.
В водных растворах произведение активностей ионов водорода и гидроксильных ионов величина постоянная при данной температуре: Кw = aH+ . aOH-. При 250С она равна 10-14. Следовательно, рКw = 14. В случае, если ионная сила раствора невелика и концентрации ионов можно принять равными активностям, можно записать: рН + рОН = 14.