Решение типовых задач
1. Определить число эквивалентности гидроксида кальция z1 и дигидрофосфата алюминия z2 в реакции: 9 Ca(OH)2 + 2Al(H2PO4)3 = 2Al(OH)3 + 3Ca3(PO4)2 + 12H2O
Решение:
Очевидно, что число эквивалентности оснований, участвующих в реакциях обмена, равно числу ионов гидроксила, замещающихся другими анионами в данной реакции.
Так как в результате химической реакции ионного обмена образовался фосфат кальция Cа3(РO4)2, то очевидно, что в молекуле гидроксида кальция прошла замена двух гидроксильных групп на фосфат-анион и значит число эквивалентности Ca(OH)2 равно двум z1=1. Используя уравнения, полученные ранее, определим число эквивалентности дигидрофосфата алюминия в данной реакции: z1.k1 = z2.k2 или 2.9 = z2.2, тогда z2 = 9.
2. К 300 мл 0,2 нормального раствора гидроксида натрия добавили 200 мл 2%-ого раствора соляной кислоты. Рассчитать рН получившегося раствора, принимая плотность всех растворов равной единице.
Решение:
При смешивании растворов щелочи и кислоты будет протекать реакция нейтрализации:
NaOH + HCl = NaCl + H2O.
Для использования закона эквивалентов выразим массовую долю раствора соляной кислоты через нормальную концентрацию, которая, очевидно, в данном случае совпадает (z = f = 1) с молярной:
Cэкв. = СМ = ω. ρ.1000/M = 0,02 . 1 . 1000/36,5 = 0,55.
Определим количество молярных масс эквивалентов щелочи и кислоты для того, чтобы узнать какое из взаимодействующих веществ находится в избытке:
nэкв. (NaOH) = V(NaOH) . Cэкв.(NaOH) = 0,3 . 0,2 = 0,06 моль экв.
nэкв. (HCl) = V(HCl) . Cэкв.(HCl) = 0,2 . 0,55 = 0,11 моль экв.
В избытке находится соляная кислота и значит, в соответствии с законом эквивалентов, колчества прореагировавших кислоты и щелочи будет составлять 0,06 моль экв. рН раствора будет определяться избытком этой кислоты: ∆nэкв. (HCl) = 0,11 – 0,06 = 0,05 моль экв.
Объем образовавшегося раствора равен сумме объемов смешанных растворов, так как изменением плотностей растворов мы пренебрегаем: V2(HCl) = 0,2 + 0,3 = 0,5 л.
Сэкв.2(HCl) = ∆nэкв.(HCl) / V2(HCl) = 0,05 / 0,5 = 0,1 моль экв.л
Концентрация протонов раствора сильной кислоты равна нормальной концентрации этой кислоты, тогда рН(HCl) = -lgCH+ = - lg Cэкв.2(HCl) = 1.
3. Вывести формулу для определения рН кислой буферной смеси, представляющей собой раствор слабой кислоты и ее соли.
Концентрация ионов водорода Н+ определяется величиной константы диссоциации кислоты: Кд = 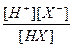 , соответствующей процессу диссоциации НХ ↔ Н+ + Х-. Концентрация аниона кислотного остатка Х- определяется суммой анионов образующихся при диссоциации кислоты и диссоциации соли: МеХ → Х- + Ме+. Диссоциация соли протекает полностью, поэтому концентрация аниона Х- возникающих при диссоциации соли равна концентрации соли, а дополнительное количество аниона возникает при диссоциации кислоты и, в соответствии с уравнением диссоциации кислоты, равно количеству протонов Н+. В результате Х- = Ссоли + [Н+]. Концентрация кислоты будет равна общей концентрации кислоты за вычетом количества продиссоциировавшей кислоты, которое, что следует из уравнения диссоциации кислоты, равно концентрации ионов водорода [Н+], т.е. [НХ] = Ск – [Н+]. Таким образом, Кд =
, соответствующей процессу диссоциации НХ ↔ Н+ + Х-. Концентрация аниона кислотного остатка Х- определяется суммой анионов образующихся при диссоциации кислоты и диссоциации соли: МеХ → Х- + Ме+. Диссоциация соли протекает полностью, поэтому концентрация аниона Х- возникающих при диссоциации соли равна концентрации соли, а дополнительное количество аниона возникает при диссоциации кислоты и, в соответствии с уравнением диссоциации кислоты, равно количеству протонов Н+. В результате Х- = Ссоли + [Н+]. Концентрация кислоты будет равна общей концентрации кислоты за вычетом количества продиссоциировавшей кислоты, которое, что следует из уравнения диссоциации кислоты, равно концентрации ионов водорода [Н+], т.е. [НХ] = Ск – [Н+]. Таким образом, Кд = 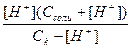 . Так как кислота слабая, количество продиссоциировавших молекул кислоты, а значит и ионов водорода, незначительно по сравнению с общим количеством кислоты и соли, поэтому в сумме (Ссоли + [Н+]) и в разности (Сk - [Н+]) концентрацией ионов водорода можно пренебречь. В результате преобразований получаем: Кд =
. Так как кислота слабая, количество продиссоциировавших молекул кислоты, а значит и ионов водорода, незначительно по сравнению с общим количеством кислоты и соли, поэтому в сумме (Ссоли + [Н+]) и в разности (Сk - [Н+]) концентрацией ионов водорода можно пренебречь. В результате преобразований получаем: Кд = 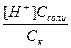 , [H+] =
, [H+] = 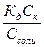 , рН = - lg[H+] = -lgK – lg(Ck/Cсоли) = рКк - lg(Ck/Cсоли) = рКк – lgCk + lgСсоли.
, рН = - lg[H+] = -lgK – lg(Ck/Cсоли) = рКк - lg(Ck/Cсоли) = рКк – lgCk + lgСсоли.
4. Ионная сила какого из трех растворов солей NaCl, MgCl2, MgSO4 будет наибольшей, если молярная концентрация всех солей одинакова?
Решение:
Запишем уравнения диссоциации солей в растворах:
а) NaCl → Na+ + Cl-
б) MgCl2 → Mg2+ + 2Cl-
в) MgSO4 → Mg2+ + SO42-
Пусть концентрация всех солей равна См. Тогда молярные концентрации ионов натрия и хлора в растворе NaCl тоже будут равны См, в растворе MgCl2 концентрация ионов магния равна См, ионов хлора - 2См, в растворе MgSO4 концентрации сульфат-ионов и ионов магния равны См
Рассчитаем ионную силу каждого раствора по уравнению:
μ = 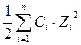 .
.
а) μ1 = 1/2(См . 12 + См . 12) = См,
б) μ2 = 1/2(См . 22 + 2См . 12) = 3См,
в) μ3 = 1/2(См . 22 + См . 22) = 4См.
Таким образом, μ1 <μ2 <μ3.