рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Предмет и задачи химии окружающей среды
Реферат Курсовая Конспект
Предмет и задачи химии окружающей среды
Предмет и задачи химии окружающей среды - раздел Химия, H.b. Гусакова Хими...
H.B. Гусакова
Химия окружающей среды. Серия «Высшее образование». Ростов-на-Дону:Феникс. - 192 с.
ВВЕДЕНИЕ
Предмет и задачи химии окружающей среды
В основе процессов, обусловливающих современное состояние биосферы, лежат химические превращения веществ. Химические аспекты проблемы охраны…Происхождение и эволюция Земли
Когда молодая Земля выросла примерно до своей современной массы, она нагрелась, в основном за счет радиоактивного распада нестабильных изотопов и…Образование земной коры и атмосферы
Можно предположить, что летучие элементы выделились (дегазировались) из мантии в результате извержений вулканов, сопровождавших образование коры.…Эволюция атмосферы и происхождение жизни
Рис. 1 Процентный состав основных элементов коры Земли Ультрафиолетовое излучение Солнца …Гидросфера
Когда поверхность молодой Земли остыла до 100 °С, водяные пары, дегазирующиеся из мантии, могли сконденсироваться. По существованию погруженных в… Круговорот между резервуарами воды в гидросфере называет гидрологическим… Большая часть дождевых осадков, попадающих на континенты, просачивается через отложения и пористые или раздробленные…ГЛАВА 1. Физико-химические процессы в атмосфере
Атмосфера — это газовая оболочка Земли, связанная с ней силой тяжести и принимающая участие в ее суточном и годовом вращении; характеризуется резко выраженной неоднородностью строения и состава. Атмосфера является самым маленьким из геологических резервуаров Земли (рис. 6). Именно ограниченные размеры делают атмосферу такой чувствительной к загрязнению. Даже внесение небольших количеств вещества может привести к значительным изменениям в ее поведении.
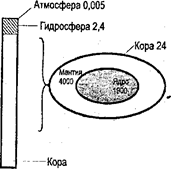
Рис. 6. Относительные размеры основных резервуаров Земли. Единица измерения 1024 г
Следует заметить, что время перемешивания атмосферы очень мало. Такое перемешивание, распространяя загрязнители на большие площади, в то же время ослабляет их действие. В противоположность этому распространение загрязняющих веществ в океане идет намного медленнее, а в других резервуарах Земли происходит только в геологических временных масштабах, равных миллионам лет.
Состав атмосферы
Атмосфера делится на слои, различающиеся температурой, степенью ионизации молекул, давлением и др.: тропосфера, стратосфера, мезосфера, термосфера и… Нижняя часть атмосферы, называемая тропосферой, хорошо мешана из-за конвекции.…Микрокомпонентные примеси в атмосфере
Fвх = Fвых = А/t, где Fвх и Fвых - это потоки в атмосферу и из нее; А- общее количество вещества… Время пребывания — величина, описывающая системы в состоянии. Это очень важное понятие, играющее центральную роль в…Таблица 2
Время пребывания следов газов в естественной атмосфере
По Brimblecombe (1986)
| Время пребывания | Концентрация, 10-7 % | |
| Диоксид углерода Оксид углерода Метан | 4 года 0,1 года 3,6 года | |
| Муравьиная кислота Азотистый ангидрид Оксид азота Диоксид азота Аммиак Диоксид серы Сероводород Сероуглерод Серооксид углерода Диметилсульфид Метилхлорид Хлороводород | 10 дней 20-30 лет 4 дня 4 дня 2 дня 3-7-дней 1 день 40 дней 1 год 1 день 30 дней 4 дня | 0,1 0,3 0,01 -0,1 0,05 0,02 0,5 0,001 0,7 0,001 |
Большинство частиц, образующихся в результате реакций, быстро удаляется с дождями и поэтому имеет время пребывания, близкое к 4—5 дням пребывания атмосферной воды. Однакоочень мелкие частицы, размером порядка 0,1—1 мкм, не столь эффективно удаляются с дождевыми каплями и имеют гораздо более длительное время пребывания.
Поскольку в глобальном масштабе атмосферу можно рассматривать как находящуюся в состоянии равновесия, была создана модель, в которой атмосфера представлена как система, имеющая источники, резервуар (это сама атмосфера) и стоки, пребывающие в хрупком равновесии. Источники должны быть достаточно стабильными в течение длительного периода, в противном случае равновесие сдвинется. Наиболее известный и тревожный пример такого сдвига — это увеличение источников СО2 из-за потребления огромных количеств ископаемого топлива в процессе человеческой деятельности, вызвавшем продолжительное возрастание концентрации CО2 в атмосфере; вследствие парникового эффекта предсказывается глобальное повышение температуры.
Существует множество источников микрокомпонентных примесей в атмосфере, которые можно разделить по различным категориям, например, геохимические, биологические и антропогенные.
Геохимические источники
Системы, где твердые или жидкие частицы распределены в газовой фазе, называются аэрозолями. Обычно размеры частиц аэрозолей ограничивают интервалом… Отличительное свойство аэрозольных систем - их неустойчивость. Седиментация,… В свою очередь, проявление каждого из этих факторов зависит от свойств самих аэрозолей.Биологические источники.
Кроме того, живой лес играет большую роль в обмене газов атмосферой. Основные газы атмосферы О2 и СО2 вовлечены в процессы дыхания и фотосинтеза.… Лимонен содержится в лимонном, апельсиновом маслах, сосновой хвое, еловых… Леса являются также источниками органических кислот, альдегидов и других органических соединений.Антропогенные источники
Если говорить о транспорте, и прежде всего автотранспорте, то примерное содержание основных компонентов выхлопных газов двигателей внутреннего…Таблица 3
Содержание основных компонентов выхлопов двигателей внутреннего сгорания (ДВС)
| Компонент | Двигатель | |
| бензиновый | дизельный | |
| Моноксид углерода | 0,5 - 12,0 об. % | 0,001 - 0,05 об. % |
| Водород | 0,1-5,0об.% | - |
| Кислород | 0,3-8,0 об. % | 2,0-18 об. % |
| Азот | 74-77 об. % | 76 -78 об. % |
| Оксиды азота в пересчете на NOх, | 0,001-0,8 об. % | 0,0005 -0,5 об. %, |
| Пары воды | 3,0-5,5 об. % | 0,5-4,0 об. % |
| Сажа | 0,0-0,04 г/м3 | 0,01-1,1 г/ м3 |
| Альдегиды | 0,0-0,2 г/м3 | 0,001-0,01 г/ м3 |
| Углеводороды | 0,2 - 3,0 г/м3 | 0,01-0,5 г/м3 |
| Бензпирен | 10-20г/ м3 | 5-10 г/м3 |
Индустрия вносит большой вклад в загрязнение атмосферы. Анализ состава промышленных выбросов в 100 городах показал, что 85% общего выброса вредных веществ в атмосферу составляют сернистый газ, оксиды углерода и аэрозольная пыль. Половина остальных 15% специфических вредных веществ приходится на углеводороды, другая – на аммиак, сероводород, фенол, хлор, сероуглерод, фтористые соединения, серную кислоту. Рассматривая вопросы, связанные с аэрозолями антропогенного происхождения, нельзя не упомянуть о смогах.
Смоги
Смог (англ. smoke - дым, fog — густой туман) - видимое загрязнение воздуха любого характера. Смог возникает при определенных условиях: большом количестве пыли и газов в воздухе и длительном существовании антициклонных условий погоды (областей с высоким атмосферным давлением), когда загрязнители скапливаются в приземном слое атмосферы. Смог вызывает удушье, приступы acтмы, аллергические реакции, раздражение глаз, повреждение растительности, зданий и сооружений.
Выделяют три типа смога: ледяной (аляскинского типа); влажный (лондонского типа); сухой, или фотохимический (лос-анжелесского типа).
Наиболее изучен влажный смог. Он обычен для мест с высоко относительной влажностью воздуха и частыми туманами. Это способствует смешиванию загрязняющих веществ, их взаимодействию химических реакциях. Эти загрязняющие вещества, непосредственно выброшены в атмосферу, они называются первичными загрязнителями. Главными токсичными компонентами влажного смога являются чаще всего СО2 и SO2. Печально знаменит случай, когда в 1952 г. влажный смог в Лондоне унес более 4 тысяч жизней.
Фотохимический смог - вторичное загрязнение воздуха, возникающее в процессе разложения первичных загрязняющих веществ солнечными лучами. Главный ядовитый компонент - озон.
Ледяной смог возникает при очень низких температурах и антициклоне. В этом случае выбросы даже небольшого количества загрязняющих веществ приводят к возникновению густого тумана, состоящего из мельчайших кристалликов льда и, например, серной кислоты.
Топливо обычно состоит из углеводородов и обычный процесс сгорания его идет согласно уравнению:
«4СН» +5О2 → 4СО2(г) + 2Н2О(г) (1.13)
топливо + кислород → диоксид углерода + вода.
Этот процесс не производит впечатления особо опасной деятельности, поскольку ни С02, ни вода не являются токсичными. Рассмотрим, однако, ситуацию, когда в процессе сжигания имеет место недостаток кислорода, что может случиться внутри двигателя или котла. Теперь уравнение можно записать так:
«4СН» +3О2 → 4СО(г) + 2Н2О(г) (1.14)
топливо + кислород → моноксид углерода + вода.
Здесь образуется оксид углерода (СО), ядовитый газ. Если кислорода еще меньше, можно получить углерод (т. е. сажу):
«4СН»+ О2 → 4С(г) + 2Н2О(г) (1.15)
топливо + кислород → «сажа» + вода.
При низких температурах и в случаях относительно небольшого количества О2 реакции пиролиза (т. е. реакции, когда разрушение происходит в результате нагревания) могут вызвать изменения в расположении атомов, приводящие к образованию полициклических ароматических углеводородов в процессе сжигания. Наиболее печально известен — бензо(а)пирен, соединение, вызывающее рак.
Таким образом, несмотря на то, что сжигание топлива первоначально кажется безвредным, оно может привести к образованию ряда загрязняющих соединений углерода.
Кроме того, загрязнение воздуха могут вызвать вещества, входящие в состав топлива. Наиболее распространенной примесью в ископаемом топливе является сера (S), частично представленная в виде минерала пирита, FeS2. В некоторых углях может содержаться до 6% |серы, которая превращается при сжигании в SO2
4 FeS2 (тв) + 11 О2 (г) → 8 SO2(г) + 2Fe2О3. (1.16)
В топливе присутствуют и другие примеси, но сера всегда считалась наиболее типичным промышленным загрязнителем воздуха. Сажа, СО, СО2 и SO2 являются первичными загрязнителями.
Диоксид серы хорошо растворим и поэтому может растворяться в атмосферной воде, которая конденсируется вокруг частиц, например, дыма:
SO2 (г) + H2О(ж) ↔ H+(водн) + HSO-3(водн) (1.17)
Следы металлов-загрязнителей железа (Fe) или марганца (Мп), катализируют переход растворенного SO2 в H2S04:
2HSO-3(водн)+ О2(водн) ↔ 2H+(водн)+2SO2- 4(водн)(1.18)
Серная кислота обладает большим сродством к воде, поэтому образовавшаяся капелька дополнительно адсорбирует воду. Капельки постепенно растут и «туман-убийца», влажный смог, сгущается достигая очень низких значений рН.
Переход в XX в. к топливам, получаемым из бензина, привел к возникновению совершенно нового вида загрязнения воздуха, связанного с более высокой летучестью жидких топлив. Автотранспор как важнейший потребитель жидкого топлива стал основным источником современного загрязнения воздуха. Однако загрязнители, которые действительно вызывают проблемы, сами по себе не выбрасываются автотранспортом. Они образуются в атмосфере в результат реакций первичных загрязнителей, таких, как NO, с несгоревшим топливом, поступающим непосредственно из автомобилей. Химические реакции, приводящие к образованию вторичных загрязнителей протекают наиболее эффективно при солнечном свете, поэтому возникающее загрязнение воздуха называется фотохимическим смогом.
Воздух - в основном смесь О2 и N2. При высокой температуре пламени молекулы в воздухе могут распадаться и даже молекулы сравнительно инертного N2 подвергаются реакциям:
О(г) + N2(г) → NO + N(г) (1.19)
N(г) + О2(г) → NO(г) + О(г). (1.20)
Согласно уравнению (1.20) образуется атом кислорода, который входит в уравнение (1.19). Однажды возникший в пламени атом кислорода будет воссоздаваться и участвовать во всей цепочке реакций, приводящих к образованию NO. Если просуммировать эти две реакции, получим
N2(г) + О2(г) → 2NO(г (1.21)
Уравнения показывают, как оксиды азота образуются в пламени. Они появляются потому, что топливо сжигается в воздухе, а не в О2. Кроме того, некоторые топлива содержат соединения азота в качестве примесей, ив результате продукты сгорания этих примесей , служат источником появления других оксидов азота. Окисление оксида азота в смоге дает диоксид азота, бурый газ. Этот цвет означает, что газ поглощает свет (с длиной волны менее 310 нм), фотохимически активен и претерпевает диссоциацию:
NО2(г) + hν → NO(г) + О(г) (1.22)
Таким образом, согласно уравнению (1.22), вновь возникает оксид азота, но также одиночный и реакционноспособный атом кислорода, который может вступать в реакции с образованием Оз:
О(г) + О2(г) → О3(г) (1.23)
Озон – это единственный загрязнитель, который наиболее ясно характеризует фотохимический смог. Однако О3, который предоставляет такую проблему, не выбрасывается автомобилями (или любым основным загрязнителем). Это вторичный загрязнитель.
Итак, летучие органические соединения, высвобождаемые благодаря использованию топлив на основе бензина, способствуют превращению NO в NО2 (и лежат в основе фотохимического смога).
В процессе окисления углеводородов в атмосфере особо нужно отметить роль радикала ОН*. Рассмотрим метан (СН4) в качестве простого примера этого процесса:
ОН(г)+СН4(г) →Н2О(г)+ СН-3(г) (1.24)
СН-3(г) + О2(г) →СН3О2(г) (1.25)
СН3О2(г) + NO(г) →СН3О(г) + NО2(г) (1.26)
СН3О(г) + О2(г) → НСНО (г) + НО-2 (г) (1.27)
НО-2 (г) + NO(г) →НО-(г) + NО2(г) (1.28)
Эти реакции показывают превращение оксида азота (NO) в NO2|и простого алкана типа СН4 в альдегид, в данном случае формальдегид (НСНО). Заметим, что радикал ОН* воспроизводится в конце цепочки реакций, поэтому может считаться в некотором роде катализатором. Несмотря на то, что реакция протекает в фотохимическом смоге воздействие радикала ОН* на большие и более сложные органические молекулы достаточно быстрое. Альдегиды также могут претерпевать воздействие радикалов ОН*:
СН3СНО(г) + oh(г) → СНзСО(г)+ Н2О(г) (1.29)
(Ацетальдегид)
СНзСО(г)+ О2 (г) → СНзСОО2(г) (1.30)
СНзСОО2(г) + NO(г) → NО2(г) + СНзСО2(г) (1.31)
СНзСО2(г) → СН-3(г) + СО2(г). (1.32)
Метил-радикал (СН-3) из уравнения (1.32) может возвращаться в уравнение (1.25).
Важным дополнением к этому ряду реакций является следующая:
СНзСОО2(г) + NО2(г) → СНзСОО2 NО2 (1.33)
(ПАН)
приводящая к образованию раздражающего глаза пероксиацетилнитрата (ПАН).
Полный список различий влажного и фотохимического смогов приводится в табл. 4
Таблица 4 Сравнительная характеристика влажного и фотохимического смогов
| Характеристика | Лос-Анжелес | Лондон |
| Температура воздуха | От 24 до 32оС | От-1до 4оС |
| Относительная влажность | <70% | 85% (+туман) |
| Тип температурных изменений | Падение на высоте 1000м | Излучение на высоте нескольких сотен метров |
| Скорость ветра | <3м/ с | Безветренно |
| Видимость | < 0,8-1,6 км | <30м |
| Месяцы наиболее частого проявления | Август - сентябрь | Декабрь - январь |
| Основные топлива | Бензин | Уголь и бензин |
| Основные составляющие | Оз, NO, N02, СО, органические вещества | Частички вещества.СО, соединения S |
| Тип химической реакции | Окислительная | Восстановительная |
| Время максимального сгущения | Полдень | Раннее утро |
| Основные воздействия на здоровье | Временное раздражение глаз (ПАН) | Раздражение бронхов, кашель (SO2/копоть) |
| Повреждающие материалы | Трескается резина (О3) | Железо,бетон |
Радиоактивное загрязнение атмосферы
Радиоактивностью называется, самопроизвольное превращение неустойчивого изотопа одного химического элемента в изотоп другого элемента,… Промежуток времени, в течение которого разлагается половина первоначального… К основным видам радиоактивного распада относятся α-распад, β-распад, электронный захват и спонтанное…Основные радиоактивные изотопы, обнаруживаемые в атмосфере после ядерного взрыва
Во время ядерных взрывов радиоактивные вещества находятся в газообразном состоянии и по мере понижения температуры конденсируются в аэрозольное…Озоновый защитный слой
Синтез и разложение озона в атмосфере представляют собой сложный процесс, поскольку поведение самой атмосферы переменчиво. Так, облучение ее Солнцем… Рассмотрим механизм образования озона в стратосфере. Расчеты по… IМеханизмы разрушения озона
Рассмотрение их влияния представляет существенный интерес как с точки зрения более углубленного понимания механизма образования озона в атмосфере,… В этом отношении большую роль играет азот как главная составная часть… NO2 + O* = NO + O2 (1.42)ГЛАВА 2. Физико-химические процессы в литосфере
Литосферой называют верхнюю твердую оболочку Земли, состоящую из земной коры и слоя верхней мантии, подстилающегоземнуюкору. Нижняя граница литосферы, проводитсяна глубинах около 100 км под континентами и около 50км под дном океана. Верхняя часть литосферы(та, где существует жизнь) - составная часть биосферы
Состав и строение литосферы
Оболочку твердой литосферы, лежащую выше поверхности Мохе, принято называть земной корой, а лежащую ниже мощную оболочку — мантией. Мощность коры… Земная кора сложена магматическими и осадочными породами, а также… Горные породы - это естественные минеральные агрегаты определенного состава и строения, сформировавшиеся в результате…Таблица7
Вариант геохимическом классификации элементов
| Литофильные | Халькофильиые | Сидерофильные | Лтяофмльйые | Биофильные |
| Li, Be, В, О, F, Na, Mg,Al, Si, Cl, K,Ca, Sc, Ti, V, Cr, Mn, Br,Rb,Sr, Y ,Zr,Nb, I,Cs,Ba,La,Hf,Ta, W, Th, U, редкие земли | S,Fe,CoNi, Си, Zn, Ga, As, Se Mo, Rh, Pd, Ag, Cd, In, Sb, Te,Hg,TI, Pb, Bi | С, Р, Fе, Со, Ni, Ge Mo, Ru, Rh Pb,Sn, Та, Re, Os, Ir, Pt, Au | H, C,N,O,Cl, Br, He, Ne, Ar, Cr, Xe, Rn | O, C, H, Р, N, S, Fе, Сa |
Литофильные - это элементы горных пород. На внешней оболочкеих ионов находится 2 или 8 электронов. Литофильные элементы трудно восстанавливаются до элементарного состояния.
Обычно они связаны с кислородом и составляют основную массу силикатов и алюмосиликатов. Встречаются также в виде сульфатов, фосфатов, боратов, карбонатов и галогенидов.
Халькофильные элементы - это элементы сульфидных руд. На внешней оболочке их ионов располагается 8 (S, Se, Те) или 18 (у остальных) электронов.
В природе встречаются в виде сульфидов, селенидов, теллуридов, а также в самородном состоянии (Си, Hg, Ag, Pb, Zn, As, Sb,Bi,S,Se,Te,Sn).
Сидерофильные элементы - это элементы с достраивающимися электронными d- и f-оболочками. Они обнаруживают специфическое сродство к мышьяку и сере (PtAs2, FeAs2, NiAs2, FeS, NiS, MoS2 и др.), а также к фосфору, углероду, азоту. Почти все сидерофильные элементы встречаются также и в самородном состоянии.
Атмофильные элементы - это элементы атмосферы. Большинство из них имеет атомы с заполненными электронными оболочками (инертные газы).
К атмофильным относят также азот и водород. Вследствие высоких потенциалов ионизации атмофильные элементы с труда вступают в соединения с другими элементами и потому в природе находятся (кроме H) главным образом в элементарном (самородноном) состоянии.
Биофильные элементы - это элементы, входящие в состав органических компонентов биосферы (С, H, N, О, Р, S). Из этих (в основном) и других элементов образуются сложные молекулы углеводов, белков, жиров и нуклеиновых кислот.
В настоящее время в различных организмах установлено более 60 элементов. Элементы и их соединения, требующиеся организмам в сравнительно больших количествах, часто называют макробиогенными элементами. Элементы же и их соединения, которые хотя и необходимы для жизнедеятельности биосистем, но требуются в крайне малых количествах, называют микробиогенными элементами. Для растений, например, важны 10 микроэлементов: Fe, Mn, Cu, Zn, B, Si, Mo, Cl, W, Со. По функциям эти элементы можно разделить на три группы:
1. Мn, Fe, C1, Zn, V - необходимы для фотосинтеза;
2. Mo, В, Fe - необходимы для азотного обмена;
3. Мn,В, Со, Си, Si - необходимы для других метаболических функций.
Все эти элементы, кроме бора, требуются и животным. Кроме того, животным могут требоваться селен, хром, никель, фтор, йод, олово. Между макро- и микроэлементами нельзя провести четкую одинаковую для всех групп организмов границу. В.И. Вернадский показал, что элементы, постоянно присутствующие в живых организмах, выполняют вполне определенные жизненные функции. Содержание же их в организмах зависит от химизма среды обитания, биологической специфики, экологических особенностей организма и др.
Важным компонентом литосферы являются подземные воды они вносят существенный вклад в общий водный баланс биосферы в целом. Не случайно подземные воды относят еще и к гидросфере, и называя их «подземной гидросферой». Поскольку речь идет о подземных водах, то естественно, чтоих присутствие, свойства, распределение во многом определяются свойствами пород, такими, как пористостъ, водопроницаемость, влагоемкость, водоносность. Формально все породы по отношению к воде можно разделить на водопроницаемые и водоупорные. Однако в геологическом масштабе пространства и времени водоупорных пород в природе не существует. Даже такие жесткие породы, как базальт и гранит, дают микротрещины уже при ничтожных подвижках сейсмического порядка.
Вода в породах может находиться в свободном и связанном состоянии. В свободном состоянии в пространстве между частицами пород она подчиняется силам земного притяжения (гравитации) либо частично удерживается в капиллярах пород менисковыми силами. Образно это можно сравнить с водой, пропитывающей губку.
В связанном состоянии вода в породах может быть либо в пленочном, либо в адсорбированном виде, удерживаясь между зернами пород адсорбционными силами. Говоря о связанной воде, следует иметь в виду две формы ее связи: физически связанную и химически связанную. Химически связанная вода - это так называемая кристаллизационная вода. Она прочно связана с кристаллами минералов химическими силами и входит в состав минерала. Примером может служить медный купорос CuSО4*5H2О. Физически связанная вода, в свою очередь, может быть как прочносвязанной с породами, так и рыхлосвязанной.
Прочносвязанная вода удерживается физическими законами - громадными давлениями в недрах. Рыхлосвязанная вода обволакивает частицы породы. Она обладает повышенной вязкостью, может очень медленно передвигаться по поверхности частиц породы, как жидкость. На эту воду не оказывает влияния гравитация, и замерзает она не при нуле, а при минус 1,5°С. Количество физически и химически связанных вод в составе минерала может быть подчас весьма значительным, достигая 60 - 65 вес.%.
Важными характеристиками, связанными с отношением пород к воде, являются влагоемкость и водоотдача.
Влагоемкостъю называют способность горных пород вмещать и удерживать определенное количество воды. Высокой влагоемкостью обладают глины, средней,- мелкие пески, слабой – галечники. Влагоемкость зависит от размера частиц: чем меньше их размер, тем больше влагоемкость.
Водоотдача - это отношение количества воды, которое может отдать порода, к общему содержанию воды в ней. Здесь зависимость обратная: процент водоотдачи тем больше, чем крупнее частицы породы. Вода, заполняющая поры, трещины и пустоты пород, может находиться в них во всех трех фазах - твердой, жидкой и газообразной, из которых первая наиболее характерна для зон вечной мерзлоты. В парообразном отношении подземная вода может конденсироваться до жидкости и переходить из жидкости в пар. Она передвигается из областей с повышенными давлением и температурой в области с более низкими их значениями.
Передвижение гравитационных подземных вод происходит главным образом тремя путями: флюацией, диффузией и фильтрацией.
Флюацией называется «вливание» воды в какую-либо емкость в породах. Например, в известняках в результате выщелачивания в земной поверхности образуются, воронки, которые продолжаются вглубь многочисленной системой трубок, каналов, каверн и пустот, иногда даже пещер. Стекающая с поверхности дождевая и талая через эти воронки будет проникать в породы. Флюация происходит преимущественно под влиянием силы тяжести.
Диффузия сводится к перемещению подземных водных растворов с мест с большей концентрацией в места с меньшей. Скорость этого процесса, хотя и невелика, но все же реально ощутима в геологическом масштабе времени. Сюда же следует отнести и iосмос - медленное проникновение одной жидкости в другую через |полупроницаемые перегородки.
Фильтрация - это просачивание воды по мелким порам породы. Именно таким образом дождевая вода проникает в песок. Фильтрация протекает под влиянием гравитации, а также может происходить в сторону снижения давления и температуры. Под влиянием давления пород и газов она может протекать и снизу вверх. Что касается скорости фильтрации, то она значительно выше скорости диффузии и зависит от многих факторов (пористости пород, вязкости водногораствора, градиента давления и т. д.).
Процессы выветривания
Физическое выветривание является механическим процессом, в результате которого порода размельчается до частиц меньшего размера без существенных… Химическое выветривание вызывается водой - особенно кислой водой - и газами,… Растворение. Простейшая реакция выветривания — это растворение минералов. Молекула воды эффективна при разрыве ионных…Общие для большинства почв реакции
Сложность состава почв, большой набор химических соединений обусловливают возможность одновременного протекания различных химических реакций и… Итак: буферность почв обусловлена большим набором временно протекающих…Катионный обмен
ПCa,Mg + 4КС1 ↔ ПК4 + CaCl2 + MgCl2 (2.15) Это означает, что почва содержала в обменной форме и Са+2 и Mg2+ которые были… В дерново-подзолистых почвах таежных лесов в обменной форме присутствуют ионы Са2+ , Mg2+, К+, Н+, Аl3+. В черноземах,…Потенциальная кислотность почв
ПH+ + КС1 → ПК+ + НС1, или (2.16) ПAl3+ +3KCI→ ПK+3 +AlCl3 + Al(OH)3 + 3HCI (2.17) И в том и в другом случае в растворе появляется некоторое количество НС1, что и создает кислую реакцию среды.Щелочность почв
Щелочность почв неблагоприятно сказывается на их химических и физических свойствах. Под действием щелочной среды почвы расплываются, теряют… Засоление почвы. В бессточных впадинах сухих регионов страны, в приморских… Однако легкорастворимые соли сравнительно подвижны, и их довольно просто удалить из почвы путем обычного промывания…Окислительно-восстановительные режимы
Fe2+ - ẽ → Fe3+ (2.19) Восстановитель ОкислительГумификация
Функции гуминовых веществ в почвах разнообразны и чрезвычайно важны. Они аккумулируют элементы питания растений, защищают почвенные минералы от… Таким образом: 1. любая почва имеет очень сложный химический состав как по набору и количественному соотношению химических элементов,…Химическое загрязнение и охрана почв
Насчитывают не менее 6 типов антропогенно-технических воздействий, которые могут вызвать разного уровня ухудшение почв. В их числе: 1) водная и… Охрана почв заключается в том, чтобы предотвратить или свести к минимуму все… Химическое загрязнение почв может быть вызвано следующими причинами: 1) атмосферным переносом загрязняющих веществ…ГЛАВА 3. Физико-химические процессы в гидросфере
Гидросфера - составная часть биосферы, непрерывная оболочка системы вода- пар, состоящая из соленой воды (моря, океаны), пресной воды (реки, озера, водохранилища), твердой воды (снежный покров, ледники), а также пронизанной водой или парамиводы литосферы и атмосферы.
Гидросфера находится в состоянии непрерывного движения, развития, обновления. Ежегодно с поверхности Земли испаряется 0,5 млн. км3 воды, что составляет половину объема всех водоемов суши. Водяные пары атмосферы обновляются в течение десяти суток. Вода рек в результате стока сменяется каждые 12 суток. Вода озер обновляется каждые 10 лет. Воды мирового океана полностью сменяются каждые 3 тыс. лет, а в самой малоподвижной форме воды - в ледниках - полный водообмен происходит за 8,5 тыс. лет.
Большая часть поверхности нашей планеты, около 71%, покрыта мировым океаном, составляющим 97% всех поверхностных вод Земли и около половины всех вод литосферы.
Поперечник Земли (экваториальный диаметр) равен 12760 км, а средняя глубина океана в его современном ложе составляет 3700 м. Следовательно, толщина слоя океанической воды в среднем равна лишь 0,03% земного диаметра. В сущности, это тончайшая водяная пленка на поверхности Земли, пленка, играющая, подобно озоновому защитному слою, исключительно важную роль в биосфере.
В
|
0 1000 2000км
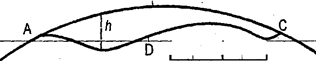
Рис. 14. Выпуклость и вогнутость дна океана
Объем Мирового океана составляет немногим более 0,1% объема земного шара, а по массе он еще меньше - всего 0,023% массы Земли.
Относительно небольшие объем и глубина Мирового океана по сравнению с объемом и диаметром земного шара приводят к тому, что дно океана фактически не является впадиной, «ямой»: оно выпуклое, а не вогнутое. На рисунке 14 линия АВС соответствует ширине Атлантического океана, равной 5800 км. Глубина океана на этом профиле не превышает 6000м; в данном масштабе это не толще линии АВС, следовательно, дно океана на всем профиле выпуклое. Оно было бы вогнутым (в виде впадины) лишь в том случае, если бы лежало ниже хорды ADC, но тогда глубина превышала бы 800 км.
Живые организмы играют огромную роль в круговороте воды. Весь объем гидросферы (около 1,5 млрд. км3) проходит через живое вещество за 2 млн. лет.
Все воды планеты представляют собой растворы разного состава и различной концентрации. Среди растворенных в воде веществ можно выделить пять групп: главные ионы; биогенные элементы (С, Н, N, Р, Si, Fe, Mn), из которых состоят организмы; растворимые в воде газы: О2, N2,CО2, углеводороды и инертные газы; микроэлементы; органические вещества. Химический состав примесей пресной воды сильно отличается от состава примесей морской. Основные ионы речных вод: Са2+, Mg2+, Na+, K+, НСОз-, SО4-, Сl-. В речной воде преобладают карбонаты и гидрокарбонаты; из катионов наибольшие концентрации имеют кальций и магний. Однако химический состав пресных вод (рек, озер, грунтовых вод) значительно варьирует и зависит преимущественно от трех факторов: химии элементов, режимов выветривания, биологических процессов (см. далее).
Подавляющую часть морской соли составляют не карбонаты, а хлориды. В этом состоит главное отличие морской воды от речной. К тому же солевой состав морской воды (на всей Земле!) постоянен - это главнейшая закономерность вхимии океана.
Концентрация растворенных солей определяет величину солености океана. Соленость определяется как вес в граммах неорганических ионов, растворенных в 1 кг воды. Семь ионов (Na+, Mg2+, К+, С1- , I-, SО42-, НSOз-) составляют более 99 % от всех ионов в морской воде, и соотношения их, напомним, постоянны во всех океанах Земли. Следовательно, на основании анализа одного иона можно по пропорции вычислить концентрацию всех остальных и соленость. Плотность морской воды, как и передача света и звука, зависит от солености. Соленость измеряется по проводимости электрического тока через воду (электропроводность). Измеренные значения выражаются относительно известного стандарта; таким образом, соленость не имеет единицы измерения, хотя во многих старых учебниках солености выражают как части на тысячу (ppt или %о) граммов на литр.
Воды открытого океана имеют средние значения солености 32-37, в большинстве около 35. В дельтах значения падают до величины ниже 1 по мере приближения к источнику пресной воды. В гиперсоленых средах соленость может превышать соленость морской воды, достигая значений более 300.
Важной химической характеристикой поверхностных вод является водородный показатель (рН). Выделение CO2 в результате дыхания и разложения вызывает понижение рН в природных водах, потому что при соединении СО2с водой образуется слабая (слабодиссоции-рующая) кислота Н2СОз:
Н2О + СО2 ↔ Н2СОз ↔ Н2СОз + Н+ (3.1)
С другой стороны, поглощениеCO2 в процессе фотосинтеза приводит к уменьшению количества Н2СОз и Н+, т. е. к росту рН. Отсюда можно утверждать, что рН в водах регулируется равновесием СО2 и карбоната кальция:
Н2О + СО2 ↔ Н2СОз (3.2)
СаСОз (тв) + Н2СОз ↔ Са2+ + 2НСОз-. (3.3)
Видно, что повышение количества СО2 увеличивает содержание Н2СОз, что, в свою очередь, вызывает уменьшение содержания карбоната кальция, а уменьшение содержания СО2 приводит к осаждению карбоната кальция. Вода, содержащая Н2СОз и НСОз-, обладает буферными свойствами, поэтому достаточно большие изменения концентрации Н+ могут не приводить к сильному изменению рН.
Результирующие соотношения между молекулами и ионами, атмосферным СО2 и твердым карбонатом кальция приводят к формированию буферного раствора с рН = 8,0 - 8,4. При этом не исключено, что активность органического вещества или другие локальные причины могут образовать на некоторое время более низкие (до б) и более высокие (до 10) значения рН.
Существенной характеристикой, особенно важной для нормального протекания фотосинтеза, является прозрачность воды. За условную прозрачность морской воды принята глубина моря, на которой белый диск диаметром 30 см становится невидимым.
Важной характеристикой природных вод является их жесткость. Как известно, различают жесткость карбонатную (временную) и некарбонатную (постоянную). Первая обусловлена присутствием в воде бикарбонатов - Са(НСОз)2 и Mg(HCО3)2, вторая - сульфатами
CaSО4 и MgSО4 или их хлоридами. Карбонатная жесткость устраняется кипячением или прибавлением к воде Са(ОН)2
Са(НСОз)2 + Са(ОН)г → 2СаСОз↓ +2Н2О. (3.4)
Постоянная жесткость устранима прибавлением к воде соды:
CaSО4 + Na2CO3 → СаСОз↓+ NaSО4 (3.5)
Сумма временной и постоянной жесткости воды составляет общую жесткость, выраженную в миллиграмм-эквивалентах ионов Са2+ и Mg2+ на литр воды. Вода с жесткостью менее 4 мг-экв/л называется мягкой, от 4 до 8 - средней, от 8 - 12- жесткой, больше 12 мг-экв/л -очень жесткой. Жесткость отдельных естественных вод колеблется в весьма широких пределах. Для открытых водоемов она часто зависит от времени года и погоды. Наиболее «мягкой» природной водой является атмосферная вода, почти не содержащая растворенных солей.
Пресные воды подземной гидросферы
К естественным запасам подземных вод обычно относят объем свободной - химически не связанной, движущейся главным образом под влиянием силы тяжести -…Химия пресных поверхностных вод
По химическому составу воды озер в самом первом приближении можно разделить на пресные и соленые. Состав воды пресных озер обусловлен поступлением… Соленые воды крупных озер (типа Каспийского и Аральского) являются реликтовыми… В составе солей доминируют хлориды натрия, магния, кальция и сульфаты натрия и магния. Наиболее часто встречаются…Химия воды и режимы выветривания
Основные речные системы протекают по разнообразным типам пород, захватывая растворенные продукты реакций выветривания. Наиболее легко выветриваемыми… На химию основных растворенных ионов рек влияет испарение. Испарение…Растворенные твердые вещества пресных вод
Алюминий, как правило, не растворяется в процессах выветривания, однако становится растворимым при низких и высоких значениях рН. В простейшем… А1(ОН)з(тв) + ОН-(водн) ↔ А1(ОН)4-(водн), (3.7) А1(ОН)з(тв) ↔ Al3+(водн) + ЗОН-(водн). (3.8)Биологические процессы
Все фотосинтезирующие растения поглощают свет и превращают его в химическую энергию с помощью молекулы хлорофилла. Освобождаемая энергия… свет С02(г) + Н2О(ж) → СН2О(тв)+О2(г) (3.9)Диаграммы Eh-pH
Из диаграммы становится ясно, что гематит (Fе2Оз) обычно устойчив в окислительных условиях при рН выше 4. Растворимый Fe3+ присутствует только в… Рис. 15. Диаграмма Eh - рН для железаПитательные вещества и эвтрофикация
Дистрофные (гр. trophe — пища, dys - отсутствие, отрицание) водоемы характеризуются превышением скорости деструкции органических веществ над… Олиготрофные (oligo - бедный) водоемы имеют сбалансированные скорости… В эвтрофных (еu — хороший, избыточный) водоемах наблюдается цветение водорослей и накопление органических веществ,…Кислотные осадки
Основной причиной выпадения кислотных дождей считается интенсификация промышленной деятельности человека. Во второй половине XXв с увеличением… Итак: - большие количества атмосферных загрязнителей, выделяющихся за счет сгорания топлива, промышленного производства, от…А)
 б)
б)
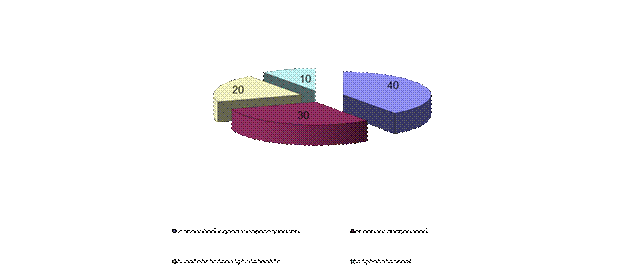
Рис.16. Количество выбросов оксидов серы (а) и азота (б) в атмосферу от различных
источников
При этом SО2 и NОх считаются главными предшественниками кислотных дождей, после превращающимися в серную и азотную кислоты. Процесс превращения диоксида серы в сульфат в атмосфере протекает различными путями и приводит к образованию различных продуктов окисления: SOз, H2SO4, (NH4)2SO4, NH4HSO4 и т. д.
Возможные механизмы атмосферных процессов окисления SO2 характеризует следующая таблица:
Таблица 9 Возможные атмосферные процессы окисления SO2
1) SO2 + hν (240 - 340 нм) —>SO2* (SO2* возбужденная молекула)
2) SO2*+ O2 —> (SO4)*
3)SO2+O+M—>SO3+M
4) SO2 + Оз —> SO3 + O2
5) SO2+ НO2* —> SO3 + ОН*
б) SO2+ОН* +М—>НSОз* +М
7)S03+H2O—>SO3*H2O—>H2SO4
8) НSОз* +OH*—>H2SO4 и др.
__________________________________________________________________________________
Хотя молекулы SО2 поглощают УФ-излучение очень сильно в ближней области, поглощаемая энергия, очевидно, недостаточна для того, чтобы разорвать связь О-S-О. Под действием УФ-излучения молекула SО2 переходит в возбужденное состояние (при длине волны менее 320 нм - в синглетное возбужденное состояние, при 330 нм ≤ λ, ≤ 390 нм - в триплетное). Молекулы SO2, находящиеся в триплетном состоянии, реагируют с кислородом воздуха, происходит фотохимическое окисление SO2, а скорость процесса сильно зависит от содержания следовых количеств примесей в воздухе, таких, как NO, NO2, углеводороды.
Окисление SO2 в пределах природной тропосферы происходит преимущественно по реакциям (5) и (6) таблицы, с быстрым превращением образовавшихся радикалов НSОз* в аэрозоль H2SО4.
В целом фотохимически инициированные реакции свободных радикалов представляют собой основной механизм превращения SО2 в сульфат в нижележащих слоях атмосферы. При этом в зависимости от времени суток, времени года и степени загрязненности атмосферы скорость окисления SО2 заметно изменяется. Например, в зависимости от степени загрязнения атмосферы при солнечном свете она возрастает на порядок с переходом от чистого воздуха (0,5 % в час) к загрязненному (5 % в час), а в зимнее время (при солнечном свете) эти скорости будут в 2-3 раза ниже.
При рассмотрении проблемы кислотных дождей заслуживает внимания окисление SO2 в жидкой фазе, и, в частности, окисление в дождевых каплях. Превращение SO2 в сульфат заметно ускоряется в присутствии аммиака; сульфат аммония всегда обнаруживается в дождевой воде.
Окисление SO2 в жидкой фазе может происходить также за счет озона и пероксида водорода, источниками которых служат фотохимические реакции в газовой фазе. Нельзя не отметить и то, что окисление SO2 в каплях, содержащих частицы копоти, протекает достаточно энергично, указывая на явное влияние углеродистых материалов на процесс превращения в сульфат-ион. Это обстоятельство приобретает особое значение в загрязненных районах. В целом механизм окисления в капельной фазе за счет Оз и Н2О2, по-видимому, преобладает над другими возможными.
Важны также процессы адсорбции SO2 на атмосферных частицах с последующими превращениями в сульфат. Сам процесс сорбции включает очень быструю стадию адсорбции SO2 на поверхности и, медленную стадию диффузии в глубь частицы. Превращение в сульфат протекает быстро на щелочной пыли и не идет на нейтральной или кислой пыли, если вещество пыли не проявляет каталитических свойств за счет присутствия в ней аэрозолей солей металлов. Особую роль в рассматриваемых процессах играет влажность, увеличение которой способствует большей степени превращения в сульфат.
На тропосферный цикл азота сильное влияние оказывают оксиды азота, образующиеся при окислении азота в воздухе в ходе процессов горения. Связанный азот содержится в угле и нефти. При их сжигании (двигатели внутреннего сгорания, тепловые электростанции) азот попадает в воздух, главным образом, в виде оксида азота (П), который в присутствии кислорода воздуха образует сначала оксид азота (IY), а затем с водой - азотную кислоту:
2NO + О2 + hν = 2NО2 (3.15)
4 NО2 + О2+ 2Н2О = 4НNОз (3.16)
Образование азотной кислоты обусловлено также реакциями:
ОН* + NО2+ М→ НОNO2 + М. (3.17)
NO2 + Оз → NОз* + О2 (3.18)
в которых азотная кислота образуется за счет радикалов ОН*, фотохимически генерируемых на дневном свете. В отличие от серной кислоты азотная кислота может долгое время оставаться в атмосфере в газообразном состоянии, так как она плохо конденсируется.
Наконец, свой вклад в кислотные дожди вносит и хлористый водород, обнаруживаемый в газовых выбросах за счет сжигания и окисления хлорсодержащих веществ. Он может растворяться в атмосферной влаге и выпадать на землю с осадками, может адсорбироваться природными поверхностями в газообразном виде или может участвовать в атмосферных реакциях, например, хлористый водород способен подвергаться окислению радикалами ОН аналогично такому же процессу с участием SO2:
ОН* + НС1→Н2О+С1- (3.19)
Образующийся атомарный хлор в результате взаимодействия с водородсодержащими газами вновь превращается в НСl, а взаимодействие хлора с озоном приводит к образованию радикала СlO* с дальнейшим его превращением в устойчивый нитрат хлора ClONO2. Гидролиз этого соединения в соответствии с реакцией
ClONO2 + Н2О → НNОз + НОС1 (3.20)
приводит к появлению двух сильных кислот и имеет поэтому прямое отношение к процессам, обусловливающим появление кислотных дождей.
Многообразие реакций, которые упомянуты выше, указывает на большое число видов химических соединений, которые вводятся в тропосферу и могут оказать воздействие на окружающую среду.
В аэрозолях, находящихся в окружающей среде, сильные кислоты могут существовать в газообразном состоянии (НNОз, НС1), в форме водных капель (H2SO4), а также в виде молекулярных частиц, адсорбированных на поверхности твердых частиц. Дальнейшая судьба этих сильных кислот связана сих участием в трех процессах.
Один из них - процесс нейтрализации аммиаком, находящимся в свободном состоянии.
NH3(г) + Н2O(ж) ↔ NH3aq, (3.21)
NH3aq +(Н+ + HSO4-)aq ↔ (NН4+ + HSO4-)aq ↔
HN4HSО4 + NH3(г) ↔ (NH4)2SО4, (3.22)
NHО3(г) + Н2О(ж) ↔ NHО3aq ↔ (Н+ + НОз- )aq , (3.23)
NH3aq + (Н+ + НОз- )aq ↔ (NH4+ +NO3-)aq ↔
↔ Н2О(г) + NH4NO3(г) (3.24)
Вторым процессом является превращение нитратов и хлоридов:
2H2SO4 aq + (NO3- + Cl-)aq ↔ 2HSO4- aq + HNO3 aq + HClaq (3.25)
НNОз(г)
Наконец, третий процесс связан с переносом сильных кислот и их солей к поверхности земли посредством сухого или мокрого осаждения.
Сухое осаждение - это прямой перенос с последующей адсорбцией газов и частиц природными поверхностями (растительностью, водой, почвой).
Мокрое осаждение - косвенный перенос некоторых частиц из атмосферы к поверхности земли с дождем, снегом или градом внутри или на поверхности частиц осадков.
Спектр влияния кислотных дождей очень широк. Действие кислых дождей на почвы неоднозначное. В северных, таежных зонах они увеличивают вредную кислотность почв, способствуют повышению содержания в почвах растворимых соединений токсичных элементов — свинца, алюминия. Алюминий в почвенных минералах обычно связан в недоступной форме. Подкисление переводит Аl из твердой фазы почвы в фазу раствора, причем увеличение геохимической подвижности его зависит от количества и природы присутствующих в почве органических лигандов (например, гуминовых и фульвокислот). Доступность и токсичность Аl для животных и растений сильно зависит от природы соединений А1, кислотности почв, потенциала окисления и микробной активности, а также от стабильности или лабильности лигандов.
При щелочных значениях рН преобладает А1(ОН)4-, тогда как при рН 4 доминирует Al3+; в критической области рН -от 4 до 7 судить о том, какие именно формы преобладают, является затруднительным. Как моноядерные гидроксокомплексы (АlOН2+ А1(ОН)2+, А1(ОН)з), так и полиядерные комплексы Aln(OH)m(3n-m) считаются в подобных системах растворенными формами. Идентифицированы также коллоидный гидроксид алюминия и различные формы осажденного А1(ОН)з (тв). В настоящее время неоспоримо доказано, что алюминий - это реальный токсический агент, металл выщелачивается в больших количествах из почв при подкислении. Алюминийсодержащая буферная система может замещать обычную гидрокарбонатную буферную систему, и при рН, близких к 5, токсичность алюминия максимальна.
Показателем влияния кислотных дождей является подкисление природных вод. Замечено, что во множестве кислых рек и озер происходит интенсивный рост водорослей и мхов. Многие водоросли в процессе фотосинтеза в кислой воде неактивны. Накопление водорослей при низких значениях рН, вероятно, обусловлено меньшим разложением и уменьшением поедания их беспозвоночными животными. Минерализация водных организмов в 'кислых растворах замедляется, что приводит к накоплению вещества на дне озер и увеличению скорости образования мхов. Плотные студенистые грибковые подстилки уменьшают количество кислорода, необходимого для аэробного разложения. В конечном счете уменьшается возврат в цикл фосфора, который имеет большое значение для продуктивности озер. Нельзя не отметить, что при всем этом имеет место также изменение состава донных беспозвоночных, составляющих пищу для рыб и весьма чувствительных индикаторов изменения рН. Так, при рН ниже 4,5 не обнаруживаются никакие ракообразные, улитки, мидии, и при этом не может жить никакая имеющая промысловое значение пресноводная рыба. Скорее всего, низкий рН препятствует размножению рыб, убивая икру.
Снижение численности рыб влечет за собой исчезновение животных, которые питаются рыбой: белоголового орлана, гагар, чаек, норки, выдры и др. Численность земноводных (лягушек, жаб, тритонов), возможно, также сокращается.
 Наконец, показательным примером может служить влияние кислотных дождей на архитектурные сооружения и памятники. Обычные материалы для каменной кладки - это известняк, мрамор, песчаники, базальт, гранит. Кроме того, используются и искусственные материалы такие, как кирпич, бетон, различные известковые растворы. Эти материалы в основном состоят из карбонатов и силикатов, все обладают высокой чувствительностью к воздействию кислых осаждений и к присутствию атмосферного SO2. Так, например, при действии кислот на мрамор протекают следующие реакции:
Наконец, показательным примером может служить влияние кислотных дождей на архитектурные сооружения и памятники. Обычные материалы для каменной кладки - это известняк, мрамор, песчаники, базальт, гранит. Кроме того, используются и искусственные материалы такие, как кирпич, бетон, различные известковые растворы. Эти материалы в основном состоят из карбонатов и силикатов, все обладают высокой чувствительностью к воздействию кислых осаждений и к присутствию атмосферного SO2. Так, например, при действии кислот на мрамор протекают следующие реакции:
H+, H2O
СаСОз → Cа2+- + 2НСО3- (3.26)
H2O, SO2 H2O, O2
СаСОз → СаSOз·2Н2О + СО2 →CaSO4·2H2O (3.27)
Основной реакцией, ответственной за разрушение мрамора и повреждение памятников, является образование сульфата на поверхности этих материалов. При этом окисление SO2 до SO3 происходит за счет каталитического действия поверхностных примесей: копоти, влаги, Fе2Оз, а также благодаря окисляющим серу бактериям.
Выводы:
- кислотный дождь изменяет величину рН рек и озер и может вызвать их биологическую смерть;
- при поглощении почвами кислотный дождь выщелачивает основные природные минералы (калий, кальций, магний) и, унося ихв подпочвенный слой, лишает деревья и растения питательных веществ;
- под влиянием кислотных дождей возрастает геохимическая подвижность алюминия, приводящая одновременно со снижением рН к возрастанию его концентраций и изменению его форм;
- кислотные дожди способствуют разрушению каменной кладки, а так же сооружений и памятников.
Однако кислотные дожди в ряде случаев могут быть и полезны. В частности, они обогащают почвы азотом и серой, которых на очень больших территориях явно недостаточно для получения высоких урожаев. Если же такие дожди выпадают в районах распространения карбонатных, а тем более щелочных почв, то они снижают щелочность, увеличивая подвижность элементов питания, их доступность растениям. Поэтому полезность или вредность каких-либо выпадений необходимо рассматривать конкретно и дифференцированно по типам почв.
Океаны
Океаны, безусловно, являются крупнейшими резервуарами гидросферы и существуют по меньшей мере уже 3,8 миллиардов лет. Жизнь на Земле, вероятно, возникла в морской воде, и океаны важны для смягчения колебаний глобальной температуры. Речные воды, дренирующие сушу континентов, попадают в океаны через дельты. Здесь пресные воды смешиваются с морской водой. Химический состав морской воды сильно отличается от состава пресной, и это различие оказывает влияние на перенос (миграцию) некоторых растворенных и твердых компонентов. Кроме того, человек часто нарушает природные химические процессы прибрежных областей как посредством загрязнения потока пресной воды, так и за счет хозяйственной деятельности, сосредоточенной вблизи дельт и мелких морей.
Мировой океан в последние десятилетия стал объектом глубоких всесторонних исследований, поскольку ресурсы океана грандиозны, как и он сам. Выделяют две группы ресурсов: одна из них биохимического характера, другая - физического.
Говоря о ресурсах биохимического характера, прежде всего необходимо помнить, что океан является важным источником пищевых ресурсов. Мировой улов рыбы в последние годы составляет 63 млн. т в год. В общем улове в настоящее время рыба составляет 90%, моллюски - 5%, ракообразные - 3%, морские растения - 1,5%. В океане обитает свыше 300000 видов живых организмов, от микроскопических водорослей до самых крупных на планете животных - 160-тонных синих китов. А между тем в океане пока эксплуатируется лишь 0,0001% первичной продукции. Большая часть растительного мира океана — это микроскопические фитопланктоновые организмы (прикрепленные ко дну водные растения занимают очень небольшую часть), которые в основном и являются первичной продукцией моря. Объем ежегодной продукции фитопланктона в мировом океане оценивается величиной 500 млрд. т. На основе первичной продукции развиваются все другие морские организмы - бактерии, зоопланктон, рыбы, морские звери.
Океан является грандиозным источником минеральных ресурсов. В мировом океане сосредоточено около 5 • 1016 т минерального сырья. Больше всего в океане хлора, натрия, магния, кальция, калия. В океане относительно много урана, серебра, золота. Полезные ископаемые океана можно классифицировать следующим образом:
1) сырье в недрах под океаном (нефть, газ, уголь, сера, железная руда);
2) прибрежные рассыпные месторождения (ильменит, монацит, циркон, магнетит, вольфрам, золото, алмазы, платина);
3) полезные ископаемые морского дна (железо-марганцевые конкреции и фосфиты).
Процессы в дельтах и эстуариях
Дельта - устьевая часть реки, в которой происходит разгрузка переносимого материала. Очертания такого участка отдаленно напоминают букву Δ… Эстуарии - воронкообразный в плане залив, образующийся при затоплении морем… Существует много различий между химизмом континентальных поверхностных вод и морской водой. В частности, морская вода…ГЛАВА 4. Особенности распространения, трансформации и накопления загрязняющих веществ в окружающей среде
Были рассмотрены физико-химические процессы в атмосфере, океанах, на суше. Был обсужден круговорот химических веществ в пределах одной геосферы. Теперь же следует обсудить не отдельные геосферы, а их совокупность, интегрированную систему: вода, воздух, твердые вещества. Геосферы не существуют в изоляции - между ними происходят крупные и продолжительные перемещения веществ. Вынос вещества из геосферы может мало влиять на нее, но иметь сильное воздействие на «принимающую» геосферу. Например, природный поток восстановленной газообразной серы из океанов в атмосферу практически не влияет на химизм морской воды, но уже играет ведущую роль в химии атмосферы, а также оказывает влияние на количество образующихся облаков.
Изменения веществ в окружающем среде
Для предсказания того, как эта система может измениться в будущем в результате человеческой деятельности или воздействия других факторов,… Важно выяснить временной масштаб изменений: быстрые они (краткосрочные) или… Необходимо также изучение пространственного распространения изменений содержания веществ - локальных, региональных,…Изменения во времени
В соответствии с законами термодинамики вся Вселенная стремится к состоянию с большей энтропией, а установление состояния с большим порядком… Геохимические и геофизические процессы, которые на протяжении всей… Землетрясения за короткий промежуток времени изменяют картину окружающего мира. Хотя причины их возникновения не…Пространственные изменения
Локальные краткосрочные естественные изменения окружающей среды - результат, например, землетрясений, наводнений, бурь; флуктуации плотности… Антропогенные локальные изменения окружающей среды можно рассматривать как… Локальные и региональные изменения вызывают вещества, относительно широко распространенные и используемые на больших…Распространение в окружающей среде
Причиной неконтролируемого глобального и регионального накопления химических продуктов является их тенденция к распространению, т. е. свойство… Скорость первой стадии распространения, а именно выход за пределы района… В этой связи в понятие «применение» входит также технология применения, например, осуществляется распыление пестицида…Перенос между различными средами
Рис. 19. Схема процессов переноса вещества между различными средами Распределение химических соединений между воздухом, водой и почвой происходит в соответствии с их физико-химическими…Перенос почва — вода
Коэффициент адсорбции почвы определяется как отношение концентрации адсорбированного вещества на твердом теле к его концентрации в водном растворе… Уравнение адсорбции Ленгмюра (изотерма адсорбции) описывает зависимость… Х K1*K2*CeПеренос вода — воздух
Скоростью улетучивания называют поток массы вещества, проходящий через границу вода — воздух. Она определяется как количество вещества, проходящее… F=KΔС, (4.4) где F —поток вещества, выраженный в единицах массы за единицу времени на единицу площади; ΔС — разность…Перенос почва -—воздух
Переход вещества из почвы в атмосферу путем диффузии в природных условиях называют летучестью из почвы, а обратный процесс — сухим осаждением в… Прежде чем начать обсуждение процесса летучести химических веществ из почвы,… R*TПоступление и накопление в живых организмах
Обогащение организмов элементами или веществами по отношению к их содержанию в окружающей среде является одной из основных функций любого живого… Таблица 9Сравнение содержания химических элементов в морской воде и теле рачка Calanus finmarchicue
Под коэффициентом обогащения или аккумуляции понимают отношение концентрации вещества в организме к концентрации того же вещества в окружающей среде… Не используемые организмами природные вещества либо не активны и не… Понятия, используемые при обсуждении процессов усвоения и накопления химических веществ в водных организмах:Географический и биотический перенос
Биотический перенос химических веществ организмами после их потребления и аккумулирования происходит в результате активного перемещения животных, а… Атмосферная миграция — важнейший путь перемещения химических веществ в… Нормальная океаническая циркуляция имеет определенное значение для глобального переноса, однако только на периоды…Геохимические барьеры
Оба типа геохимических барьеров подразделяются на три класса: физико-химические, биогеохимические и механические. Механические барьеры… Биогеохимические барьеры по своей сути представляют накопление химических… На физико -химических барьерах изменение концентрации веществ связано с их отложением из растворов при изменении…Круговороты макроэлементов
Круговорот воды, включающий переход ее из жидкого в газообразное и твердое состояния и обратно, - один из главных компонентов абиотической… На базе большого геологического круговорота возникает круговорот органических… В отличие от геологического, биологический круговорот характеризуется ничтожным количеством энергии. На создание…Таблица 10
Вещества, попавшие в окружающую среду исключительно в результате.человеческой деятельности
Влияние этих химикатов на окружающую среду сложно предсказать, поскольку обычно не существует подобных им природных соединений, чье поведение уже… Возвращаясь к первой категории химических изменений, отметим, что они… имел место в течение всей истории Земли (4,5 млрд. лет). Возникновение жизни на планете оказало огромное влияние на…Углерод
Поступление углекислого газа в атмосферу в современных условиях происходит в результате: 1) дыхания всех организмов; 2) минерализации органических… Схема обмена углерода между его соединениями в океане приведена на рис. 20.…АТМОСФЕРА
____________________________________________________________________ Водные растения ==СО2 ↔Н2СО3 ↔НСО3- ↔СО32-ВОДА
|


|

____________________________________________________________________
ДОННЫЕ ОТЛОЖЕНИЯ СаСО3(тв) СаСО3(тв)
Рис. 20. Схема обмена углерода между его соединениями в океане
Следует лишь добавить, что на больших глубинах, где фотосинтез из-за недостатка света прекращается, идет образование СО2 за счет разложения органического вещества в результате распада. В верхнем 500-метровом слое окисляется в среднем до 87% первичной продукции. В донные осадки попадает 0,1% органического вещества, из этого количества только 0,0001 часть идет на формирование нефти. При этом в океане ежегодно оседает все вносимое реками количество гидрокарбонатов (1,7 млрд. т), кальция (0,5 млрд. т) и частично магния (0,36 млрд. т).
Потребление углекислого газа происходит главным образом:
1) в процессе фотосинтеза; 2) в реакциях его с карбонатами в океане; 3) при выветривании горных пород.
Основные химические реакции процесса фотосинтеза. Фотосинтез включает сложный комплекс различных по природе реакций. В этом процессе происходит перестройка связей в молекулах СО2 и Н2О, так что вместо прежних связей углерод - кислород и водород - кислород возникает новый тип химических связей: углерод -водород и углерод - углерод:
О Н Н
// | |
С 94,26 ккал/моль → Н– С – С– С ......
| |
О ОН О Н
Н-О-Н 59,69 ккал/моль
В результате этих превращений возникает молекула углевода, которая представляет собой концентрат энергии в клетке. Таким образом, с химической точки зрения фотосинтез является перестройкой химических связей.
Можно сказать, что фотосинтез - это процесс синтеза органических соединений, идущий за счет световой энергии. Суммарное уравнение фотосинтеза показывает, что кроме углеводов образуется также и кислород, хотя оно и не дает представления о механизме этого процесса:
6CO2 + 6Н2О → C6H12O6 + 6О2 + Q (4.10)
Фотосинтез - это сложный, многоступенчатый процесс, в котором, с биохимической точки зрения, центральная роль принадлежит хлорофиллу - органическому веществу зеленого цвета, которое поглощает квант солнечной энергии. Механизм процессов фотосинтеза может быть представлен следующей схемой:
Н2О
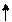
 hν + ОН- световая
hν + ОН- световая
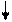
 → хлорофилл → +
→ хлорофилл → +
ẻ + ОН- → Н2О + О2 фаза
 Н+
Н+

 АДФ + Ф → АТФ
АДФ + Ф → АТФ
темновая
6СО2 + 24Н+ = С6Н12О6 + 6Н2О фаза
Как видно из схемы, в световой фазе фотосинтеза избыточная энергия «возбужденных» электронов порождает два процесса: фотолиз - с образованием молекулярного кислорода и атомарного водорода:
2Н2О=О2+4Н+ (4.11)
и синтез аденозинтрифосфорной кислоты (АТФ) из аденозиндифосфорной кислоты (АДФ) и фосфорной кислоты (Ф). В темновой фазе идет синтез углеводов, для осуществления которого расходуется энергия АТФ и атомов водорода, возникающих в световую фазу в результате преобразования световой энергии Солнца. Общая продуктивность фотосинтеза огромна: ежегодно растительность Земли связывает 170 млрд. т углерода Помимо того, растения вовлекают в синтез миллиарды тонн фосфора, серы и других элементов, в результате чего ежегодно синтезируется около 400 млрд. т органических веществ. Тем не менее при всей своей грандиозности природный фотосинтез - медленный и малоэффективный процесс, поскольку зеленый лист использует для фотосинтеза всего 1 % падающей на него солнечной энергии.
Низкое содержание СО2 и высокие концентрации О2 в атмосфере сейчас служат лимитирующими факторами для фотосинтеза; а зеленые растения являются регуляторами этих газов. Таким образом, зеленые растения Земли и карбонатная система океана поддерживают относительно постоянное содержание СО2 в атмосфере.
Эмиссия СО2 из почвы в атмосферу колеблется очень сильно в зависимости от особенностей почв и климатических условий, в том числе от содержания органического вещества в почве, влажности, температуры. Наибольшая эмиссия СО2 при прочих равных условиях характерна для тропических почв.
Полагают, что до наступления индустриальной эры потоки углерода между атмосферой, материками и океанами были сбалансированы. Влияние человека на круговорот углерода
проявилось в том, что с развитием индустрии и сельского хозяйства поступление СО2 в атмосферу стало расти за счет антропогенных источников. Главная причина увеличения содержания CO2 в атмосфере - это сжигание горючих ископаемых, однако, свой вклад вносят и транспорт, и уничтожение лесов. Сельское хозяйство также приводит к потере углерода в почве, так как фиксация СО2 из атмосферы агрокультурами в течение лишь части года не компенсирует полностью высвобождающийся из почвы углерод, который теряется при окислении гумуса (результат частой вспашки).
При уничтожении лесов содержание углекислого газа в атмосфере увеличивается при непосредственном сжигании древесины, за счет снижения фотосинтеза и при окислении гумуса почвы (если на месте лесов распахивают поля или строят города). Леса - важные накопители углерода: в биомассе лесов приблизительно в 1,5, а в лесном гумусе - в 4 раза больше углерода, чем в атмосфере.

Рис. 21. Биотический круговорот углерода
Основная масса углерода в земной коре находится в связанном состоянии. Важнейшие минералы углерода - карбонаты, количество углерода в них оценивается в 9,6*1015 т. Разведанные запасы горючих ископаемых (угли, нефть, битумы, торф, сланцы, газы) содержат около 1*1013 т углерода.
Современное изменение ландшафта человеком заметно повлияло на поток углерода из резервного фонда в обменный. Можно представить, какое огромное количество СО2 выделится, если будет сожжена хотя бы половина фонда горючих ископаемых. Одновременное уменьшение поглотительной способности растительного покрова Земли может привести к сбою механизмов саморегуляции и природного контроля. Если содержание углекислого газа в атмосфере вдвое превысит доиндустриальный уровень (приблизится к 0,06 %), то следует ожидать потепления климата на 1,5-4,5°С. Наряду с подъемом уровня моря (в 20-м веке он уже поднялся примерно на 12 см) и перераспределением осадков, эти изменения могут привести к затоплению прибрежных районов. Известно, что уровень содержания СО2, обычный для атмосферы, т. е. около 0,03% (по объему), не обеспечивает максимальную продуктивность зеленых растений. Положительное влияние на развитие корней и на прирост наземной биомассы оказывает увеличение содержания СО2 до 2% (такое содержание встречается в газовой фазе почвы), однако при содержании СО2 около 8% уже наблюдается ингибирующий эффект.
Таким образом, некоторое дополнительное поступление СО2 в атмосферу может играть положительную роль, но все же большую экологическую опасность при этом представляет «парниковый эффект».
Таким образом, влияние человека на циклы превращения углерода по своему направлению прямо противоположно суммарному результату естественного цикла:
природный цикл
Углерод СО2 <-----------------------------------------------------------------> углерод минералов
сознательная деятельность
Кроме СО2, в атмосфере присутствуют в небольших количествах еще два углеродных соединения: оксид углерода СО и метан СН4. Как и СО2, они находятся в быстром круговороте: время пребывания в атмосфере СО2 – 4 года, для СН4 - 3,6 года, а для СО - около 0,1 года. В естественных условиях СО и СН4 образуются главным образом при неполном анаэробном разложении органических веществ и в атмосфере окисляются до СО2.
Оксид углерода — химически довольно инертный газ: в тропосфере он очень медленно окисляется кислородом и озоном воздуха. СО активно взаимодействует с гемоглобином крови и уже при очень низкой концентрации снижает ее способность переносить кислород. Содержание СО в воздухе около 0,001% (по объему) вызывает головную боль, снижение умственной деятельности и расстройство ряда физиологических функций организма.
Оксид углерода СО может продуцироваться в почвах как биологическим (выделение организмами), так и небиологическим путем. Экспериментально установлено выделение СО за счет обычных в почвах фенольных соединений, содержащих группы ОСН3 или ОН в орто- или пара-положении по отношению к первой гидроксильной группе. Общий баланс продуцирования небиологического СО и его окисления микроорганизмами зависит от окисления микроорганизмами, от конкретных экологических условий и, в первую очередь, от влажности и значения рН. Так, из аридных почв небиологический СО выделяется непосредственно в атмосферу, вызывая локальное увеличение концентрации СО.
Количество СО, попадающего в атмосферу при сгорании топлива, особенно с выхлопными газами, равно его естественному поступлению.
Углеводороды до сих пор поступают в атмосферу за счет преимущественно биологических процессов; считается, например, что до 80% поступающего в атмосферу СН4 формируется биологическим путем.
Почти не представляя опасности как самостоятельные загрязняющие вещества воздушной среды (за исключением высоких концентраций - до 10 частей на миллион и более), углеводороды обусловливают мощность и плотность фотохимического смога. При этом в результате фотохимических реакций углеводороды образуют весьма токсичные продукты: альдегиды, кетоны, пероксиацетилнитрат. Метан и другие низшие алканы, такие, как этан, пропан, накапливаясь в атмосфере, влекут за собой постепенное повышение среднегодовой температуры, что является следствием «парникового эффекта».
СН4 образуется преимущественно в болотных и затапливаемых рисовых почвах, частично в любых почвах после орошения и даже в автоморфных почвах нормального увлажнения. Эмиссия метана зависит от температуры, времени года и времени дня, уровня содержания в почвах органического вещества, внесения органических удобрений, окислительно-восстановительного потенциала. Метанобактерии образуют метан только в восстановительной среде, причем в качестве исходных веществ они используют сравнительно небольшое число простых соединений; это могут быть метанол, формальдегид, ацетат и некоторые другие. Метан устойчив в восстановительной среде, но при доступе кислорода и повышении окислительных потенциалов он уже в почве может окисляться метанотрофами с образованием СО2 и Н2О.
Элементы V и VI групп играют важную роль в химических и биохимических биосферных процессах. Азот и сера являются необходимыми элементами для формирования белков, фосфор играет важную роль в энергетических процессах. Сера, фосфор, азот — типичные органогены.
В живых организмах содержится 0,3% азота, 0,07% фосфора, 0,05% серы, в золе растений— 7% фосфора и 5% серы. Фосфор и сера образуют труднорастворимые соединения, в том числе гипс, фосфориты. Пройдя через стадию аккумуляции в организмах, они накапливаются не только в толще почв, но и в осадочных породах.
Сера, фосфор, азот — типичные неметаллы с большим числом валентных электронов; геохимическая общность рассматриваемой группы элементов проявляется в том, что их миграция и аккумуляция, подвижность и реакционная способность зависят от присутствия органических веществ, окислительно-восстановительных и кислотно-основных условий.
Сера и азот относятся к элементам, проявляющим переменную степень окисления, причем при образовании химической связи они могут выступать как доноры или как акцепторы электронов. Эти особенности обусловливают высокую химическую активность, многообразие форм соединений, участие в различных биосферных процессах.
4.4.2. Азот
Азот - важнейший элемент питания, необходимый для нормального развития растений. Он входит в состав белков (до 16-18% их массы), нуклеиновых кислот, нуклеопротеидов, хлорофилла, гемоглобина, фосфатидов, алкалоидов. Соединения азота играют большую роль в процессах фотосинтеза, обмена веществ, образования новых клеток. В формировании почвенного покрова и плодородия экосистем, в повышении продуктивности земледелия и улучшении белкового питания человека азот столь же незаменим, как углерод. Азот накапливается преимущественно в живых организмах и почвах, но не в осадочных или изверженных породах. Это обусловлено неустойчивостью соединений азота вне живых организмов, их быстрым разложением, минерализацией и активной миграцией в биосфере. В почвах азот связан с живым органическим веществом или гумусом.
В биосфере азот присутствует в газообразной форме (N2, NН3, NO, NO2), в виде соединений азотной и азотистой кислот (нитраты и нитриты), солей аммония, а также входит в состав разнообразных органических соединений.
Главным источником азота в почве является гумус. Планетарные запасы азота в почвенном гумусе составляют 6 • 1010 т, однако он находится в недоступной растениям форме и непосредственно для их питания не используется. Азот гумуса переходит в растворимые и доступные формы лишь постепенно, в результате ряда сложных и длительных микробиологических превращений.
Устойчивые соединения азота, присутствующие в почвах, представлены формами со степенями окисления -3 и +5. Вне живых организмов азот в биосфере представлен молекулами N2, неорганическими соединениями (преимущественно NH4, NO3-, NO2-) и органическими формами. В биоценозах на долю минеральных соединений азота приходится не более 1-10%.
Перечисленные соединения азота входят как в состав неспецифических органических соединений почвы, так и в состав гумусовых кислот.
Трансформация соединений азота в почвах включает следующие процессы:
1) фиксация атмосферного азота свободноживущими и клубеньковыми бактериями;
2) превращение азотсодержащих соединений органических остатков в гумусовые кислоты;
3) аммонификация органических азотсодержащих соединений;
4) нитрификация;
5) денитрификация и потеря азота в атмосферу;
6) фиксация иона NH4+ глинистыми минералами;
7) вымывание различных соединений азота с внутрипочвенным и поверхностным стоком.
Азот поступает в почву с атмосферными осадками в виде NН3. Другим естественным источником азота является его фиксация свободноживущими микроорганизмами и клубеньковыми бактериями, а также появление соединений азота при разложении растительных и животных остатков. Существенным источником азота являются техногенные поступления в виде удобрений и отходов.
Рассмотрим важнейшие процессы, составляющие баланс азота в биоценозе. Биотический круговорот азота включает ряд очень сложных процессов, основную роль в которых играют микроорганизмы. Например, распад наиболее сложных высокомолекулярных азотосодержащих органических веществ - белков идет в несколько стадий. На первой стадии происходит расщепление белков до аминокислот микроорганизмами, вырабатывающими ферменты протеазы:
БЕЛКИ → ПЕПТОНЫ → ПОЛИПЕПТИДЫ → АМИНОКИСЛОТЫ.
На второй стадии аминокислоты (RCHNHzCOOH) разлагаются бактериями, актиномицетами, грибами как в аэробных, так и в анаэробных условиях:
RCHNH2COOH + О2 → RCOOH + NН3 + CO2 ( 4.12)
RCHNH2COOH + НО2 → RCOHCOOH + NН3. (4.13)
Поскольку продуктом разложения аминокислот независимо от путей расщепления является аммиак NН3, то эта стадия называется аммонификацией. Аммонификация — процесс разложения органических веществ, протекающий с участием специфических аммонифицирующих микроорганизмов и ведущий к образованию NН3 или NH4+.
В результате белкового обмена в животных организмах выделяется мочевина СО(NН2)2, которая тоже служит источником NН3
СО(NН2)2 + Н2О → 2 NН3 + СО2 (4.14)
При аммонификации могут образовываться также сероводород H2S, индол C2Н7N, скатол C9H9N, этилмеркаптан C2H5SH. Все эти вещества обладают неприятным резким запахом, поэтому распад белков часто называют гниением.
Ион NH4+ усваивается растениями, вовлекается в процессы гумификации, частично фиксируется, а также подвергается нитрификации, он может быть выщелочен или поглощен в почвенном комплексе или необменно фиксирован трехслойными глинистыми минералами с расширяющейся решеткой. Содержание фиксированного аммония в почвах меняется от 1-2 до 10-12 мэкв/100 г почвы. Аммонификация — первая стадия минерализации азотосодержащих органических соединений.
Следующей стадией является нитрификаци.: окисление аммиака (аммония) до нитритов и нитратов. Этот процесс протекает в два этапа:
1) окисление NН3 в HNO2 через гидроксиламин NH2OH и гипонитриты (соли азотноватистой кислоты НО — N = N — ОН):
NН3 + HNO2→ NH2OH → HO—N=N—OH → HO—N=О
(при участии бактерий Nitrosomonas):
2 NН3 + ЗО2 →( 2HNО2 + 2Н2О +Q1 (суммарное уравнение); (4.15)
2) окисление N3+ до N5+ (при участии бактерий (Nitrobacter):
2HNО2 + О2 →(2HNО3 + Q2). (4.16)
Реакции нитрификации идут с выделением энергии, которую бактерии используют для своей жизнедеятельности, т. е. они являются хемоавтотрофами. Образовавшиеся при нитрификации нитриты и нитраты могут быть потенциальным источником кислорода в анаэробных условиях. Нитрификация протекает в почвах в окислительных условиях при величине окислительно-восстановительного потенциала Eh около 0,4-0, 5 В.
Нитрат-ион частично вымывается, поглощается растениями, подвергается денитрификации, замыкая биогеохимический цикл азота. Денитрификация осуществляется биологическим путем с помощью бактерий — денитрификаторов Pseudomonas, Micrococcus. Денитрификация протекает с потреблением энергии за счет жизнедеятельности бактерий.
В процессе денитрификации осуществляются следующие реакции:
О
//
HON → HO-N=O → OH-N=N-OH
↓
O N≡N=O→ N≡N
OH О
| -2Н //
HO-N=O → OH-N → HO-N
|
ОН О
или
NO3- → NO2 → NO →N2O → N2
Безазотистые органические вещества окисляются за счет нитритов и нитратов. При этом нитриты и нитраты восстанавливаются до газообразного азота, вновь поступающего в атмосферу. Суммарно:
5Сорг + 4KNО3 → 2К2СОЗ + ЗСО2 + 2N2 (4.17)
Воздух по объему почти на 80 % состоит из молекулярного азота N2 и представляет собой крупнейший резервуар этого элемента.
Поступление азота в атмосферу происходит: 1) в процессе денитрификации, т. е. биохимического восстановления оксидов азота до молекулярного газа N2; 2) с вулканическими газами и 3) с дымом, выхлопными газами. Поглощение азота из воздуха происходит: 1) в процессе азотфиксации благодаря деятельности азотфиксирующих бактерий и многих водорослей (прежде всего синезеленых), 2) в результате естественных физических процессов фиксации азота в атмосфере (электрические разряды при грозе и др.) и 3) в процессе промышленного синтеза NH3.
Минеральные соединения азота (NH4+, NО2-, NО3-) потребляются растениями при фотосинтезе. Животные, поедая растения, используют азот для построения белков протоплазмы, превращая его в органические формы.
Азотфиксация (связывание молекулярного азота) - процесс, обратный денитрификации. Оба процесса требуют энергии, которую микроорганизмы получают либо в виде солнечного света, либо в виде органического вещества.
Долгое время считалось, что фиксировать N2 атмосферы могут немногие, но широко распространенные в природе микроорганизмы, а именно: бактерии Azotobacfer и Clostndwm, клубеньковые бактерии бобовых растений - Rhizobium, сине-зеленые водоросли Aiiabaena, Nostoc и др. Затем было обнаружено, что многие водные и почвенные бактерии также обладают этой способностью. Кроме того, оказалось, что примитивные грибы (актиномицеты) в клубеньках ольхи и других деревьев (около 160 видов) фиксируют N2 не менее эффективно. В отличие от бобовых, эти фиксаторы приспособлены к бедным песчаным или болотистым почвам, где доступного для растений азота мало. Поэтому ольха, например, может увеличивать продукцию деловой древесины, если ее сажать вместе с ценными породами деревьев. Биологическая фиксация азота идет в автотрофном и гетеротрофном ярусах экосистем, в аэробных и анаэробных зонах.
Но большинство наземных растений и высших водорослей, несмотря на огромное количество азота в атмосфере, способны усваивать его лишь в виде ионов, т. е. в виде NH4+, NО2-, NО3-.
Итак, только примитивные микроорганизмы могут превращать биологически бесполезный газообразный азот в формы, усвояемые растениями. Они образуют взаимовыгодные ассоциации с высшими растениями, усиливающие фиксацию азота. Растения предоставляют бактериям «квартиры» (корневые клубеньки), защищают от избытка кислорода и поставляют необходимую энергию (органические вещества). За это растения получают азот в доступной для них форме. Для расщепления N2 бактериям необходимо много энергии на разрыв тройной связи (N=N). Бактерии в клубеньках бобовых расходуют на фиксацию 1 г атмосферного азота около 10 г глюкозы (примерно 167,5 кДж), синтезируемой растением на свету. При промышленной фиксации N2 (получение NH3) также расходуется много энергии горючих ископаемых, поэтому азотные удобрения стоят дороже любых других.
Таким образом, центральное место в биотической циркуляции азота занимает NH3 (рис. 23).
|
|

Рис. 23. Схема превращений азота в биотическом круговороте
В водоемы соединения азота поступают: с поверхностным и дренажным стоком с городских и сельских территорий; с подземными водами; с городскими и промышленными стоками; со сточными водами сельскохозяйственных производств.
В океан азот попадает в виде различных соединений с материковым стоком и атмосферными осадками. Ориентировочное содержание «связанного» азота (органический, нитратный и аммиачный) составляет для различного стока 0,6 мг/л, а в атмосферных осадках - 0,3 мг/л. Азот атмосферных осадков и азот материкового стока в сумме своей компенсируют процесс денитрификации (процесс перевода соединений азота в свободный азот) в океане, а количество азота, попадающего в донные осадки, мало. Процессом азотфиксации, поскольку он имеет ограниченное развитие, можно пренебречь. В таком случае денитрификация приводит к ежегодной потере около 0,3 г азота на 1 м2 поверхности Мирового океана (рис. 24).
АТМОСФЕРА
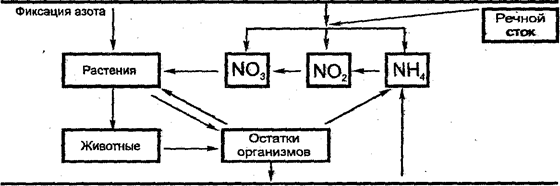
Донные отложения
Рис. 24. Схема обмена азота между его соединениями в океане
Влияние человека на круговорот азота достаточно велико.Онвыращивает на обширных площадях бобовые растения, а также промышленным способом связывает азот. Подсчитано, что сельское хозяйство и промышленность дают почти на 60 % больше фиксированного азота, чем естественные наземные экосистемы. В этом случае люди пытаются копировать природную стратегию взаимовыгодного сотрудничества, способствующую выживанию. Если бы специалистам по генной инженерии удалось индуцировать образование клубеньков у пшеницы, кукурузы, риса и других пищевых культур, это помогло бы сэкономить немало средств и энергии, избавило бы от необходимости внесения азотных удобрений. Хороших результатов можно достигнуть и сейчас, если лучше использовать бобовые в сельском хозяйстве. Бобовые растения - природные фиксаторы азота - работают активнее в среде с малым количеством азота, поэтому внесение азотных удобрений под бобовые не имеет смысла, так как выключает
биофиксацию атмосферного N2. Из азота, поступившего с удобрениями, очень небольшая часть вовлекается в круговорот повторно. Большая доля его теряется: выносится с водой, с урожаем и в процессе денитрификации. Кроме того, избыток нитратов в пище и воде может быть опасен для людей. Напрасной траты азота и энергии можно избежать, если рационально чередовать зерновые и бобовые культуры в севообороте.
Ежегодно в глобальном круговороте биотическим сообществом усваивается около 109 т азота. При этом 80 % его поступает с суши и воды и лишь около 20% добавляется «нового» азота из атмосферы.
В масштабе биосферы, благодаря механизмам обратной связи и большому резервному фонду, круговорот азота относительно совершенен. Хотя часть азота из густонаселенных областей уходит в глубоководные океанические отложения и выключается из круговорота, возможно, на миллионы лет - эта потеря в какой-то мере компенсируется поступлением его в воздух с вулканическими газами. Следовательно, извержения вулканов нельзя считать только вредными. Если бы вдруг удалось заблокировать все вулканы на Земле, то можно предположить, что от голода страдало бы не меньше людей, чем сейчас страдает от их извержений.
Антропогенная денитрификация (удаление избыточных нитритов и нитратов) и стремление к сокращению производства нитратных удобрений соответствуют природным процессам и способствуют сохранению цикличности движения азота.
В последнее время содержание N2 в атмосфере не менялось. Похоже, поступление его в атмосферу (денитрификация) и отток из атмосферы (азотфиксация) в целом уравновешены, хотя, возможно, фиксация слегка преобладает вследствие деятельности человека.
Фосфор
Для большинства химических элементов и соединений, которые обычно связаны с лито- и гидросферой, как фосфор, а не с атмосферой, характерны осадочные циклы. Циркуляция таких элементов осуществляется путем эрозии, осадкообразования, горообразования, вулканической деятельности и переноса веществ организмами. Твердые вещества, переносимые по воздуху как пыль, выпадают на землю в виде сухих осадков или с дождем.
Живым сообществам биосферы доступны в основном те химические элементы, которые входят в состав пород, расположенных на поверхности Земли. Одним из важных для биосферы элементов, недостаток которого на поверхности ограничивает рост растений, является фосфор. Циркуляция его легко нарушается, так как основная масса вещества сосредоточена в малоактивном и малоподвижном резервном фонде, захороненном в земной коре. Если «захоронение» совершается быстрее, чем обратный подъем на поверхность, то значительная часть обменного материала на длительное время выбывает из круговорота. Такая ситуация складывается часто, когда добывают фосфатные породы: свалки отходов производства возникают вблизи шахт и заводов, а часть фосфора выключается из оборота.
Особенности биогеохимического цикла фосфора заключаются в том, что в отличие от азота и углекислого газа, резервным фондом его является не атмосфера, а горные породы и отложения, образовавшиеся в прошлые геологические эпохи, т.е. в биокруговороте его практически полностью отсутствуют газообразные соединения, тогда как обязательными элементами биокруговорота углерода, азота, серы являются газообразные соединения. Круговорот фосфора представляется простым, незамкнутым циклом.
Фосфор - один из наиболее важных биогенных элементов.Онвходит в состав нуклеиновых кислот, клеточных мембран, ферментов, костной ткани, дентина. Фосфор активно участвует в процессах обмена веществ и синтеза белка, определяет энергетику клетки, активно влияет на рост растений, концентрируясь в семенах и точках роста.
Для соединений фосфора наиболее характерны следующие степени окисления: —3 (фосфин РН3), + 3 (РС13), +5 (Н3РО4). Среднее содержание фосфора в земной коре достигает 0,09%. В биотический круговорот фосфор поступает в процессе разрушения протоплазмы организмов и постепенно переходит в фосфаты, причем до 95% всех природных фосфатов составляют фосфаты кальция. В земной коре значительная часть соединений фосфора представлена разновидностями апатита, преимущественно фторапататом Са10(РO4)бF2. В апатитах также присутствуют примеси кадмия, мышьяка, хлора.
В составе органической части почвы соединения фосфора представлены фосфолипидами — около 1% органического Р, инозитолфосфатами и нуклеиновыми кислотами — 2-3% органического Р, фосфопротеинами, сахарофосфатами, фосфорилированными карбоновыми кислотами. До 60% органического фосфора представлено инозитолфосфатами; инозит, или шестиатомный насыщенный спирт циклогексангексол имеет следующую структурную формулу:
СНОН
/
НОНС СНОН
| |
НОНС СНОН
/
СНОН
Реагируя с фосфатами, он дает различной степени замещения соединения вплоть до гексазамещенных. Значительную роль в составе органического вещества почв играет фосфор гумусовых веществ — гуминовых кислот, фульвокислот. В составе гуминовых кислот содержится от 2-3 до 50-80% всего органического фосфора почвы. Ортофосфаты могут быть связаны с органическими веществами через катионные мостики — Fe, A1, Са. На долю органических соединений фосфора в почвах приходится от 10-20 до 70-80% всех запасов фосфора, поэтому органические соединения являются значительным резервом обеспечения растений фосфором.
Поступление фосфора в круговорот происходит в основном: 1) в процессе эрозии фосфатных пород (в том числе, гуано) и 2) вследствие минерализации продуктов жизнедеятельности и органических остатков растений и животных.
Образующиеся фосфаты (РО43-) поступают в наземные и водные экосистемы, где вновь могут потребляться растениями.
Потребляется фосфор растениями и животными для построения белков протоплазмы и в промышленном производстве удобрений и моющих средств (рис. 25).
Механизмы возвращения фосфора в круговорот в природе недостаточно эффективны и не возмещают его потерь. Сейчас не происходят сколько-нибудь значительные поднятия отложений на поверхность. Вынос фосфатов на сушу осуществляется в основном с рыбой. Но это не компенсирует их поток с суши в море. Морские птицы также участвуют в возвращении фосфора в круговорот (например, скопления гуано на побережье Перу). Однако перенос фосфора и других веществ из моря на сушу птицами сейчас происходит не столь интенсивно, как в прошлом.
Потери фосфора с ненарушенных покрытых лесом водосборных бассейнов невелики и компенсируются поступлениями с дождем и продуктами выветривания. Но ниже по течению рек, где деятельность человека активна, - иная картина. С увеличением степени освоения, т.е. с увеличением площадей, занятых сельскохозяйственными полями и городами, в водах рек резко возрастает содержание фосфора. В воде, стекающей с городских территорий, в 7 раз больше этого элемента, чем в воде реки, протекающей по местности, занятой лесом.
Кроме того, в стоке с освоенных территорий до 80 % фосфора содержится в минеральной форме, т. е. в виде фосфатов, а в стоке с территорий, занятых естественной растительностью, преобладают органические соединения фосфора. Однако смыв фосфорных удобрений с полей не столь велик, как азотных, так как в воде фосфаты малорастворимы, а в щелочной среде - практически нерастворимы, и поэтому задерживаются почвенными частичками. А усвоение их растениями сильно зависит от кислотности почвенного раствора и растворимости образующихся соединений (рис. 26).
Исследования показали, что в наземных экосистемах большая часть фосфора находится в связанной форме и недоступна для растений. Отсюда можно сделать очень важный для практики вывод: избыток удобрений может оказаться столь же невыгодным, как иихнедостаток. Если в почву вносится больше вещества, чем могут использовать в данный момент организмы, избыток его быстро связывается почвой и отложениями, становясь недоступным именно в тот период, когда он наиболее, необходим организмам.
Основные потери, фосфора из круговорота происходят при сбросе промышленных, городских и сельскохозяйственных сточных вод в водоемы; при применении избыточных

Рис. 25. Биотический круговорот фосфора
количеств фосфорных удобрений и фосфорсодержащих моющих средств. Производство последних в некоторых странах уже запрещено. При этом серьезные опасения вызывает также
Увеличение кислотности
--------------------------------------------------------------------------------------------------------à
—————>РO43-——----——> НРО42-———---—> Н2РО4-————>Н3РО4
| | | |
Са3(РО4)2 СаНРО4 Са(Н2РО4)2 Хорошо
Плохо растворима Малорастворима Растворима растворима
-------------------------------------------------------------------------------------------------------à
Увеличение растворимости
Рис. 26. Образование растворимых соединений фосфора в зависимости от кислотности
«цветение» воды вследствие «удобрения» ее избыточным количеством фосфатов. Следствием этих процессов, из-за массового развития и отмирания водорослей, является вторичное загрязнение воды и захоронение фосфора с остатками водорослей.
Сохранение цикличности круговорота фосфора очень важно, потому что из всех биогенных веществ, необходимых организмам в больших количествах, фосфор - один из наименее доступных элементовна поверхности Земли. Фосфор и теперь часто лимитирует первичную продукцию экосистем, а в будущем его лимитирующее значение может резко возрасти, что грозит снижением пищевых ресурсов планеты.
Однако в настоящее время явно обозначился и сформировался и такой новый процесс антропогенного происхождения - «фосфатизация» суши, или возрастание общего содержания соединений фосфора в окружающей среде. Процесс этот протекает неравномерно и наиболее интенсивно идет на территории индустриально развитых стран. Если сера, углерод уходят в газообразной форме в атмосферу, то более устойчивые соединения фосфора накапливаются в местах складирования органических отходов, свалках, полях орошения, что в итоге приводит, как и в случае соединений азота, к эвтрофикации водоемов избытком фосфатов. По данным ЮНЕСКО, признаки эвтрофикации обнаруживаются при содержании фосфора в воде свыше 15 мг/л. Антропогенные поступления представляют существенную долю в балансе фосфора. Применение удобрений, химическое загрязнение биосферы в целом, эрозионные процессы играют решающую роль в фосфатизации биосферы. Решение противоречивой проблемы - дефицит фосфора и эвтрофикация водоемов - требует разработки комплекса мер, направленных как на максимальное снижение потерь фосфора при переработке, внесении удобрений, так и на недопущение загрязнения окружающей среды соединениями фосфора.
4.4.4. Сера
Сера — биогенный элемент, необходимый для живых организмов, и обязательный элемент питания растений.
В зоне гипергенеза сера проявляет все известные для нее степени окисления: (-2), (+4), (+6), из них наиболее характерны (-2) и (+б). Это обусловливает существенную роль окислительно-восстановительных реакций и разнообразие процессов миграции (Перельман, 1966). Восстановленные формы серы (S°, H2S, сульфиды) легко окисляются до сульфатов как микробиологическим путем, так и абиотическим. Темпы окисления зависят от растворимости присутствующих в почве сульфидов.
В далекую геологическую эпоху образования земной коры господствующие тогда условия (высокая температура и недостаток кислорода в атмосфере) благоприятствовали образованию соединений серы только одного определенного типа, а именно продуктов ее непосредственного взаимодействия с металлами. В результате ко времени появления на земной поверхности жидкой воды вся или почти вся сера была связана в виде сульфидов. В соответствии с приводимой ниже схемой круговорота серы действие воды и углекислого газа на расположенные близко к поверхности Земли сульфиды привело к постепенному превращению их в углекислые соли и выделению сероводорода, например, по реакции:
CaS + СО2 + Н2О = СаСО3 + H2S+19 ккал. (4.18)

 2 Н2SO4 и сульфаты 4
2 Н2SO4 и сульфаты 4
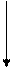
 S белок
S белок
 3
3
1 5
Н2S и сульфиды
Взаимодействуя с кислородом, а также под влиянием серобактерий сероводород окислялся до свободной серы:
2H2S + О2 =2Н2О + 2 S +126 ккал. (4.19)
При недостатке кислорода сера накапливалась, создавая залежи. При избытке кислорода воздуха она постепенно переходила в серную кислоту:
2S + 2О2 + 2Н2О = 2Н2SО4 (4.20)
Образовавшаяся серная кислота, реагируя с различными солями, содержащимися в почве или воде, превращалась в сульфаты:
СаСОз + H2SО4 = CaSО4 + СО2 + Н2О (4.21)
Наряду с окислительными процессами в цикле участвуют и восстановительные процессы, ведущие к переводу серной кислоты в сероводород. В частности, сульфаты, уносимые водами рек в моря, образовали пласты, которые в результате геологических смещений земной коры попадали в более глубокие слои Земли. Здесь под влиянием повышенных температур они реагировали с увлеченными при осаждении органическими веществами, давая сероводород, например, по схеме:
CaSО4 + СН4 à CaS + СО2 + 2Н2О à СаСО3 + H2S + Н2О (4.22)
Получающийся сероводород выходил на поверхность Земли либо прямо в газообразном состоянии, либо предварительно растворившись в подземных водах. По такому же механизму, но только под влиянием бактерий восстановительные процессы протекают, когда разложение органических веществ происходит под слоем воды, содержащей растворимые сульфаты. Другой восстановительный путь проходят сульфаты, содержащиеся в почве.
Сера в почвах представлена органическими и неорганическими соединениями, соотношение которых зависит от типа почвы и от глубины залегания генетического горизонта. Наиболее доступная растениям сульфатная форма составляет не более 10-25% от общего содержания. Основные поступления серы в почву происходят с пылью и кислыми дождями, причем с пылевой фракцией серы поступает в десятки раз больше, чем с кислыми дождями.
Часть серы, поступившей в почву из атмосферы, закрепляется в подстилке, часть мигрирует вниз по профилю. В среднем количество поглощенной подстилкой серы может составлять до одной трети от количества элемента, поступившего с атмосферными осадками.
Поступающий с осадками сульфат-ион SО4-2 (а также и NО3-) поглощается живыми организмами, а при избытке анионов — взаимодействует с твердыми фазами почвы. Избыток сульфат-ионов может поглощаться путем хемосорбции на оксидах Fe и А1, при этом выделяется ОН-, нейтрализующий Н+
2FeOOH + SО4-2 à (FeO)2SO4 + 2OН-. (4.23)
Потери серы из почвы происходят за счет микробиологического восстановления сульфатов до летучих газообразных соединений типа сероводорода, дисульфида углерода. Реакции окисления восстановленных соединений серы протекают в почвах достаточно быстро при доступе атмосферного воздуха. Сульфиды и элементная сера постепенно окисляются даже кислородом воздуха; в аэробных условиях в окислении принимают участие различные группы тионовых и серобактерий. Элементная сера появляется в почвах как промежуточный продукт окисления сульфидов железа или вносится с химическими загрязняющими веществами. Окисление серы в почвах протекает ступенчато, причем конечным продуктом является серная кислота или сульфаты:
S à S2O3-2 à S4O6-2 à SO3-2 à SO4-2
Тиосульфат тетратионит сульфит сульфат
Окисление пирита кислородом воздуха также приводит к накоплению серной кислоты:
2FeS2 + 2H2O + 7О2 à 2FeSО4 + 2H2SО4. (4.24)
С помощью бактерий Thiobacillus ferrooxidans сульфат железа (II) окисляется до Fe2(SO4)3
4FeSО4 + О2 + 2H2SО4 à 2Fе2(SO4)3 + 2Н2О (4.25)
Особый интерес представляют реакции восстановления сульфатов сульфатредуцирующими бактериями. Сульфаты неустойчивы в анаэробных условиях и при достаточном содержании органического вещества восстанавливаются анаэробными бактериями рода Desul-fovibrio, причем происходит подщелачивание среды:
Na2SO4 + Fe(OH)3 + 9H+ à FeS + 2NaOH + 5Н2О (4.26)
Деятельность сульфатредуцирующих бактерий приводит к накоплению в почвах сульфидов железа и соды.
В илах, обогащенных органическим веществом, протекают следующие реакции:
Na2SO4 à Na2S + 2O2 (4.27)
Na2S + 2Н2О à 2NaOH + H2S (4.28)
H2S + О à Н2О + S (4.29)
2NaOH + СO2à Na2CO3 + Н2О (4.30) 2Fe(OH)2 + 2H2S à 2FeS + 4H2O (4.31)
2FeS + 3Oà Fe2O3 + 2S (4.32)
В почвах с непромывным водным режимом и при аэробных условиях сера накапливается в виде гипса или в составе легкорастворимых солей. При умеренном содержании гипс положительно влияет на свойства почв и даже используется для мелиорации солонцов. При высоких уровнях накопления гипс образует плотные скопления, что резко ухудшает физические свойства почв.
В почвах, подверженных техногенному загрязнению, происходит значительное возрастание не только валового содержания серы, но также и водорастворимых сульфатов. При загрязнении почв серой резко увеличивается число сероокисляющих микроорганизмов Thiobacillus novellus и сероокисляющих грибов, что служит хорошим индикатором загрязнения биосферы соединениями серы.
Содержание серы в растениях зависит от физиологических особенностей вида. Мхи, папоротники, хвощи содержатболее 2% серы в золе. Среди двудольных растений обогащена серой зола Лебедевых (5%), крестоцветных (4%), в хвое содержание серы не превышает 0,06% для незагрязненных биогеоценозов.
В настоящее время значительным источником серы стали техногенные выбросы предприятий металлургической, нефтяной и других отраслей промышленности.
Диоксид серы SO2 составляет более 95% всех техногенных выбросов серосодержащих веществ в атмосферу. Около 96% мирового выброса SOz приходится на северное полушарие. Сравнительно большая доля стран Восточной и Западной Европы по этим видам загрязнения атмосферы объясняется высоким уровнем использования бурого угля в энергопроизводстве. Есть основания полагать, что ежегодные выбросы SOz в атмосферу будут возрастать в связи с ростом потребления топлива.
Присутствие оксидов серы в атмосфере оказывает негативное влияние на жизнедеятельность животных и растений: диоксид серы взаимодействует с кислородом воздуха с образованием SO3 и в конечном счете H2SO4
2SO2 + O2 à 2SO3 или S02 + O à SO3 (4.33)
SО3 + H2O à H2SO4 (4.34)
Наиболее благоприятные условия протекания этой реакции находятся в пределах озонового слоя атмосферы, где в процессе распада молекул озона на О и O2 генерируется атомный кислород. В результате в стратосфере на высоте порядка 18 км присутствует слой с высокой концентрацией SO3.
Эмиссия значительных количеств соединений серы существенно повышает естественные уровни концентрации элемента вблизи источников выброса. В урбанизированной зоне содержание соединений серы в атмосферном воздухе обусловливается антропогенными эмиссиями. В индустриально-региональной зоне антропогенный вклад существенно превышает воздействие природных источников, а в геохимически чистой превалирует природный фактор. Установлено, что в индустриальных регионах до 60% почвенной кислотности определяется образованием в атмосфере серной кислоты. Биогеохимические циклы природной и антропогенной серы связаны с уровнями ее содержания в породах, почвах, живых организмах.
Хотя в природном круговороте серы наряду с окислительными процессами протекают и восстановительные, последние все же компенсируют первые. В результате антропогенной деятельности сульфиды постоянно переводятся в сульфаты (производство серной кислоты, выплавка металловиз сульфидных руд). В целом основные черты биогеохимического круговорота серы сводятся к следующему:
1) обширный резервный фонд в почве и отложениях и меньший - в атмосфере;
2) ключевая роль в быстро обменивающемся фонде принадлежит специализированным микроорганизмам;
3) взаимодействие геохимических и метеорологических процессов (эрозия, осадкообразование, выщелачивание, дождь) с сугубо биологическими процессами (продукция и разложение).
Круговороты второстепенных элементов
Галогены
Самым распространенным из галогенов является хлор, который содержится в биосфере в макроколичествах, тогда как фтор, бром, йод являются микроэлементами. Все галогены имеют сходное строение внешнего электронного слоя.
Галогены в природных условиях играют важную роль в биохимических процессах. Их анионы подвижны в земной коре, хотя могут проявлять литофильные свойства.
Соединения хлора
В природной обстановке хлориды в значительных количествах накапливаются только в засоленных почвах, преимущественно в регионах с аридным климатом.…Соединения йода
В почвах содержится от 0 1 до 40 мг/кг йода при среднем содержании порядка 3 мг/кг. В почвах ряда островов (Ирландии, Японии, Новой Зеландии)… Загрязнения окружающей среды йодом и его соединениями возможно при сжигании…Соединения брома
Основными антропогенными источниками брома могут быть фумиганты (метилбромид) или пестициды, используемые в газообразном состоянии, калийные… Содержание брома в почвах колеблется от 5 до 40 мг/кг. В торфах и почвах,… Избыток брома токсичен для растений.Соединения фтора
Фториды щелочных металлов растворимы в воде и их растворимость уменьшается в ряду KF > NaF > LiF. Фтор образует 92 минерала, в том числе… Фторсодержащие минералы обычно находятся в горных породах и почвах в… Главными источниками фтора в окружающей среде, в том числе в почве, являются:Фреоны
Группа фтор- и фторхлоруглеводородов жирного ряда, главным образом метана, которые, благодаря своим термодинамическим свойствам, нашли широкое применение в практике как хладоносители в холодильных машинах, называется фреонами (слово фреон происходит от лат. frigor—холод). Фреоны представляют собой газообразные или жидкие вещества, как правило, хорошо растворимые в органических растворителях, а также во многих смазочных маслах и практически нерастворимые в воде. Фреоны негорючие, не образуют взрывоопасных смесей с воздухом и относительно инертны. Они не действуют на большинство металлов (до 200°С), стойки к окислителям, кислотам. При контакте с открытым пламенем фреоны разлагаются с образованием токсичных дифтор- и фторхлорфосгенов. Известны следующие фреоны: CF4 - фреон-14; ССlF3 - фреон-13; CCI2F2 - фреон-12, CHClF2 - фреон-22; СС13F - фреон-11; СВrF3 -фреон-13. Наибольшее значение имеет фреон-12 (Ф-12), получаемый при действии фторида сурьмы (III) на тетрахлорид углерода:
ЗСС14 + 2SbF3 → ЗСС12F2 + 2SbС13. (4.35)
Производство Ф-12 достигает 85% всей мировой продукция фторорганических соединений. Фреоны устойчивы к действию серной кислоты и концентрированных щелочей, не взаимодействуют с большинством металлов. Фреоны нетоксичны для организма, однако их воздействие на окружающую среду может иметь и негативные последствия — образование «озоновой дыры».
Тяжелые металлы
Районы, в которых концентрация химических элементов (соединений) в силу природных причин оказывается выше или ниже кларкового уровня, называют… К числу тяжелых металлов относят хром, марганец, железо, кобальт, никель,… Поступление тяжелых металлов в биосферу вследствие техногенного рассеяния осуществляется разнообразными путями.…Железо
Железо относится к числу сидерофильных элементов (типичных металлов), имеющих химическое сродство к углероду (с образованием карбонатов), к фосфору (фосфаты), к сере и кремнию (сульфаты, сульфиды, силикаты). Помимо железа к сидерофильным элементам относят кобальт, никель, молибден, технеций, рутений, родий, осмий, иридий и платину. При окислительном выветривании и почвообразовании образуются и накапливаются в биосфере минералы железа (III), преимущественно оксиды и гидроксиды, слаборастворимые и геохимически относительно инертные. В почвах обнаружены многие минералы железа (II) и железа (III), в том числе оксиды: гематит Fе2О3, магнетит FeO•Fе2О3; гидроксиды: гетит FeOOH, лимонит 2Fе2О3•ЗН2О; сульфиды; кислые железистые минералы: ярозит [NaKFe6(OH)12 (SO4)4], феронатрит [Nа3Fе(SO4)3•ЗН2О], фосфаты, силикаты, арсенаты железа, органожелезистые соединения, аморфные осадки гидроксидов. Различные соединения железа играют существенную и весьма сложную роль в почвенных процессах в связи со способностью элемента менять степень окисления с образованием соединений различной растворимости, окисленности, подвижности.
Почвенно-геохимическая судьба соединений железа обусловлена кислотно-основными, окислительно-восстановительными условиями, аэрированностью и увлажненностью почвы, микробиологической активностью. Восстановление железа (и марганца) происходит при Eh ниже +300 - +400 мВ, В автоморфных почвах, как правило, преобладают соединения железа (III) при значениях Eh около +400 - +650 мВ; в гидроморфных почвах, если Eh опускается до +300 - +400 мВ, представлены либо обе формы железа, либо железо (II).
Биогеохимический цикл соединений железа и марганца представляется следующим. Выветривание и почвообразование сопровождаются десиликацией пород и потерей оснований, окислением соединений железа и марганца, образованием осадков оксидов и гидроксидов. Во влажных субтропиках образуются кислые коры выветривания (красноземы, бокситы), обогащенные окисленными соединениями железа, марганца, а также титана и алюминия. Этот процесс осложняется растущей кислотностью среды, наличием органического вещества, деятельностью микроорганизмов. При развитии восстановительных процессов активизируется геохимическая миграция железа и марганца в виде хелатных соединений, гидрокарбонатов, сульфатов.
С водными потоками геохимически активные соединения железа, марганца интенсивно мигрируют, но при смене теплового, окислительно-восстановительного, кислотно-основного режимов, минерализации органического вещества (иными словами, при прохождении потоков через геохимические барьеры) соединения железа и марганца осаждаются и аккумулируются. Выветривание, переувлажнение,кислотно-анаэробное почвообразование способствуют постоянному пополнению подвижных соединений железа и марганца.
Аэрация восстановленных горизонтов почвы, различных отвалов, терриконов приводит к реакциям окисления; при этом присутствующие в таких материалах сульфиды железа преобразуются в сульфаты железа с одновременным образованием серной кислоты:
4FеS2 + 6Н2О + 15O2 → 4FeSO4(OH) + 4H2SO4 (4.36)
В таких средах значения рН могут опускаться до 2,5 — 3,0. Серная кислота разрушает карбонаты с образованием гипса, сульфатов магния и натрия. Периодическая смена окислительно-восстановительных условий среды приводит к декарбонизации почв, дальнейшему развитию устойчивой кислой среды с рН 4—2,5, причем соединения железа и марганца накапливаются в поверхностных горизонтах.
Гидроксиды и оксиды железа, марганца при образовании осадков легко захватывают и связывают никель, кобальт, медь, хром, ванадий, мышьяк.
Свинец
В IV группе периодической системы особое значение имеет свинец вследствие его высокой токсичности. Свинец ингибирует ферментативные реакции, вступая в химическое взаимодействие с белками и осаждая их. Присутствие повышенных концентраций свинца в воздухе и продуктах питания представляет угрозу для здоровья человека.
В характерных для биосферы условиях свинец представлен соединениями со степенями окисления +2 и +4 (оксид РbО и диоксид свинца РbО3). Более устойчивы и распространены в природе соединения Рb(П). Наибольшее влияние на состояние свинца в почвах могут оказывать анионы: СО32-, ОН-, S2-, РО43- и SO42-. Попадающий при химическом загрязнении в почву свинец сравнительно легко образует гидроксид при нейтральной или щелочной реакции. Если почва содержит растворимые фосфаты, тогда Рb(ОН)2 переходит постепенно в Рb3(РO4)2 или другие труднорастворимые фосфаты, например плюмбогуммит РbА13Н(ОН)6(РO4)2. Эти соединения преимущественно определяют уровень содержания Рb в почвенных растворах, который в нейтральной среде близок к 10-8 моль/л.
Растворимость соединений свинца в диапазоне рН 8,5—11,0 и в восстановительных условиях при рН 2 низкая—менее 1 мг/л.
Атмосфера
Ископаемое Ископаемое топливо-3,6 топливо выпадениеХром
Хром отличается широким разнообразием состояний окисления (от +2 до +6) и способностью образовывать комплексные анионные и катионные ионы, например Сr(ОH)2+ СrO42-. В природных соединениях он имеет степени окисления +3 и +6. Высокоокисленные формы хрома менее устойчивы, чем Сr3+.
Главными источниками хрома в биосфере являются промышленные отходы (гальванические осадки, отходы кожевенных заводов и производств, где хром содержится в составе пигментов и красителей), осадки сточных вод. Другими менее важными источниками загрязнения хромом являются воды из циркуляционных систем охлаждения, производство клея, средства для стирки белья. Источниками загрязнения являются также жидкие стоки кожевенных производств, красилен, отвалы шлаков при производстве феррохрома, хромовых сталей; некоторые фосфорные удобрения содержат до 102—104 мг/кг хрома.
Поступающий из антропогенных источников Сr6+ в пресных водах восстанавливается до Сr 3+, а затем сорбируется взвесью и донными осадками. Поступление бытовых стоков в реки вызывает резкое падение содержания растворенного кислорода и образование сероводорода. Это в 2,5 — 3 раза снижает долю Сr6+ от общего содержания хрома в растворе.
Поведение хрома зависит как от рН, так и от окислительно-восстановительного потенциала. Так, при одном и том же значений Eh = 500 мВ в интервале рН 5—7 преобладаетCr (III), а при рН > 7 — Сr (VI). На поведение хрома существенное влияние оказывают органические вещества. Биогеохимические циклы хрома подробно изучены на примере экосистем пресных и соленых водоемов. Модель круговорота хрома в морской экосистеме показана на рис. 28. Установлено, что Сr6+ и органические соединения хрома не соосаждаются с гидроксидом железа в морской воде; в водах хром на 10—20% представлен формой Сr3+ на 25—40%— Сr6+, на 45 — 65% — органической формой. Поскольку хром (Ш) в кислой среде инертен (выпадая но-чтй полностью в осадок при рН 5,5), его соединения в почве весьма стабильны. Напротив, хром (VI) крайне нестабилен и легко мобилизуется в кислых и щелочных почвах. Снижение подвижности хрома в почвах может приводить к его дефициту в растениях. .
Установлено, что известкование, а также применение фосфора и органических веществ существенно снижают токсичность хроматов'в загрязненных почвах. При загрязнениинвав «ромом (VI) подкисле-ние, а затем-примеиениеловстанавливающих агентов (например, ее-pbi) исподвзуется для восстановления его до хрома (№), после чего проводится известкование для осаждения соединений-Ср (III).
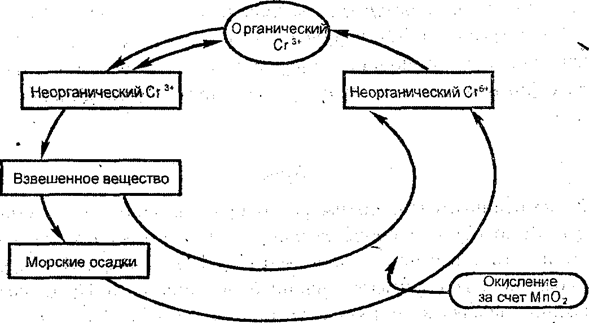
Рис. 28. Круговорот хрома в морской воде
Стронций
Ртуть
В соединениях ртуть может быть как двухзарядной, так и формально однозарядной; она характеризуется высоким потенциалом ионизации и окислительным потенциалом, является химически стойким элементом. Одной из главных особенностей иона ртути является способность к образованию комплексных соединений с координационными числами от 2 до 8. Связь «ртуть — лиганд» во всех комплексах является ковалентной. Наиболее устойчивы комплексы с лигандами, содержащими атомы галогенов, углерода, азота, фосфора, серы. Ртуть образует также значительное число комплексов с органическими реагентами, характеризующихся высокой прочностью (8-меркаптохинолин, тиомочевина). Известны и ртуть органические соединения типа RHgX или R2Hg, обнаруженные в последнее время в различных компонентах биосферы — донных осадках, природных водах.
Электростанции, работающие на угле

Рис. 29. Загрязнение озера ртутью
Ртуть встречается в природе как в самородном состоянии, так и в соединениях, образуя ртутные минералы: киноварь HgS, тиманит HgSe, ливингстонит HgS•2Sb2S3 монтроидит HgO. Ртуть входит в качестве изоморфной или механической примеси в реальгар, антимонит, молибденит, пирит, пирротин, сфалерит. Среднее содержание ртути в каменном угле составляет 1 • 10-6 %.
За геологическое время в биосферу в результате природных процессов (вулканическая деятельность) поступило около 1,6 • 1010 т ртути. Около 0,1% остается в океанах в растворенном виде.
Биогеохимический цикл ртути Hg - пример круговорота природного элемента, который почти не влиял на организмы до наступления индустриальной эры. Ртуть химически малоподвижна, а концентрации ее в природе невелики. Разработка месторождений и промышленное использование увеличили поток ртути в атмосферу. Соответственно увеличился и ее сток с поверхностными водами. Увеличение содержания ртути, как, впрочем, и других тяжелых металлов (кадмия, меди, цинка, хрома) в окружающей среде стало серьезной проблемой. Ртуть используется в различном электротехническом оборудовании, термометрах, зубных пломбах, лекарствах, красках, фунгицидах и др. Больше половины расходуемой ртути не возвращается в производство. Эта означает, что она попадает в природные воды и оказывается в окружающей среде (рис. 29).
На рис. 30 показаны оценки потоков ртути в сравнении с ее потоками в доиндустриальный период. Запасы ртути указаны в прямоугольниках в сотнях тонн, а потоки (стрелки) - в сотнях тонн в год. Цифры в скобках показывают потоки до появления человека. Штрихами обозначены два новых потока, порожденных деятельностью человека
В результате разработки отложений и увеличения выбросов ртути возрастает ее количество в почвах, воде, живых организмах. При этом микроорганизмы, участвующие в круговороте, превращают ее нерастворимые формы в растворимую, очень подвижную и очень ядовитую - метилртуть. Рыбы и моллюски накапливают метилртуть до концентраций, опасных для человека, использующего их в пищу.
Трансформация веществ в окружающей среде и накопление их в живых организмах в процессе круговорота должны учитываться при использовании опасных химических элементов.
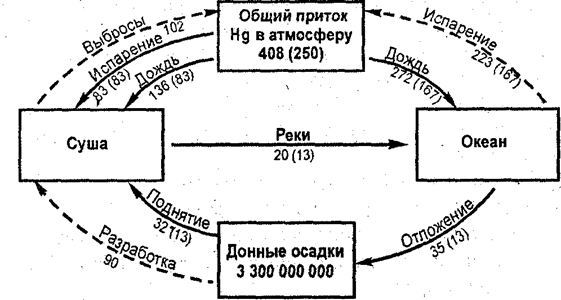
Рис. 30. Схема круговорота ртути
– Конец работы –
Используемые теги: Предмет, задачи, химии, окружающей, среды0.076
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Предмет и задачи химии окружающей среды
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов