Решение.
Титрование основано на реакции:+ AgNO3 - AgBr + KNO3
или в ионном виде:- + Ag+ - AgBr.
В растворе над осадком в любой момент титрования имеются ионы Ag+ и Br-. Раствор над осадком является насыщенным, поэтому, зная ПР образующейся соли AgBr и концентрацию реагирующих веществ, можно вычислить изменения концентраций ионов Ag+ и Br- в различные моменты титрования.
а) в данной точке в избытке остается 1 мл 0,1 н. раствора KBr, т.е. 0,1∙1 ммоль-экв. Общий объем раствора равен 100+99=199 мл. Концентрация Br- составит ммоль/мл или моль/л, т.к. концентрация Br- из AgBr пренебрегается.

Концентрацию Ag+ вычисляется из ПРAgBr как

Тогда pAg = 8,8.
б) В точке эквивалентности ПРAgBr = [Ag+]∙[Br-] = 7,7∙10-13. Отсюда:
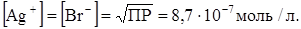 = pBr = 6,1.
= pBr = 6,1.
в) В присутствии избытка AgNO3 концентрацию Br--ионов находим из ПРAgBr как
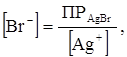 где
где 

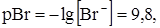

Принцип решения задач в методах осадительного титрования аналогичен другим методам титриметрического анализа. Наиболее рациональный способ расчета результатов анализа состоит в нахождении количества вещества эквивалентов веществ с последующим пересчетом на содержание веществ в граммах или в процентах.