Решение.
Поскольку в процессе титрования измеряется концентрация ионов ртути (I), то электрод должен быть из металлической ртути, на котором протекает электродная реакция: Hg22++2e→2Hg0. Для этой системы φ0(Hg22+/2Hg0)=+0,79 В (из справочника) и уравнение Нернста имеет вид: φ(Hg22+/2Hg0) = φ0(Hg22+/2Hg0) + (0,059/2)lg[Hg22+]. В начале скачка титрования концентрация определяемого иона составляет 0,1% от его исходной концентрации (без учета разбавления):
 моль/л и
моль/л и
 B.
B.
После точки эквивалентности концентрация ионов ртути (I) определяется величиной произведения растворимости образующегося в результате реакции осадка роданида ртути (I) Ks(Hg2(SCN)2)=[Hg22+]∙[SCN-]2 и избыточной концентрации роданид-ионов. Из справочника величина Ks(Hg2(SCN)2)=3∙10-20.
В конце скачка тирования избыточная концентрация ионов SCN- составляет 0,1% от концентрации рабочего раствора (без учета разбавления):
 моль/л, тогда
моль/л, тогда
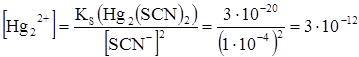 моль/л и
моль/л и
φ(Hg22+/2Hg0)=0,79+(0,059/2)lg(3∙10-12)=0,452 B.
Величина скачка титрования составляет Dφ=0,674-0,452=0,222 B.