Решение.
Строим калибровочный график А=f(C, мг/мл) и по нему находим концентрацию ионов железа 0,24 мг/мл, а затем рассчитываем массу железа в анализируемом растворе m(Fe3+)=C(Fe3+)·Vр-ра·M(Fe3+)=0,24·0,250 = 60 мг = 0,060 г.
9. КОНТРОЛЬНЫЕ ЗАДАНИЯ по теме «Инструментальные методы анализа» (контрольная работа № 3)
. Оптическая плотность при некоторой длине волны найдена равной А=0,562. Рассчитайте пропускание Т того же раствора в процентах
lgT=A-2.
. Удельная и эквивалентная электропроводность водного раствора хлорида бария при 250С равны соответственно 1,191∙10-3 Ом-1∙см-1 (за вычетом электропроводности чистой веды) и 119,1 Ом-1∙см-1∙моль-1. Рассчитайте молярную концентрацию эквивалента и молярную концентрацию хлорида бария в анализируемом растворе.
 .
.
. Кулонометрическое титрование 4,00 мл анализируемого раствора перманганата калия KMnO4 провели электрогенерированным железом (II) при постоянном токе i=50 мА в присутствии индикатора ферроина. Окраска раствора изменилась через 386 с. Рассчитайте молярную концентрацию перманганата калия в анализируемом растворе.

 .
.
. Для определения уксусной кислоты в ацетонитриле использовали метод кулонометрического титрования с помощью ионов ОН-, образующихся при электролизе воды в катодном пространстве. Какова молярная концентрация СН3СООН, если сила тока 25 мА, время электролиза 85 с, объем исследуемого раствора 60,0 см3.
. При амперометрическом титровании 10 см3 раствора цинка свежеприготовленным раствором К4[Fe(CN)6] с титром по цинку 0,002445 г/мл при Е=-1,46 В получены следующие данные:
| Объем титранта, см3 | 0,2 | 0,4 | 0,5 | 1,0 | 1,5 | 2,0 | 2,5 | 3,0 | |
| Ток, мкА |
Построить график и определить молярную концентрацию цинка в исследуемом растворе.
. Определить нормальную концентрацию свинца, если при амперометрическом титровании 10,0 см3 этого раствора с помощью сульфата калия с титром 5,34∙10-3 г/мл при Е=1,0 В получили следующие данные:
| Объем титранта, см3 | 0,5 | 1,0 | 1,5 | 2,0 | 2,5 | |
| Ток, мкА |
297. Определить степень диссоциации 0,1 М раствора HIO3, если удельная электропроводность этого раствора 4,02∙10-3 Ом-1∙см-1, а подвижности ионов  ,
,  .
.
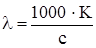 ;
;  ;
;  .
.
. Рассчитать массовую долю гексана, гептана и октана в смеси по методу внутренней нормализации (нормировки), если площади их пиков на хроматограмме равны 305, 508 и 122 мм2 соответственно.
 и т.д.
и т.д.
. Вычислить высоту, эквивалентную теоретической тарелке, если время удерживания некоторого компонента составляет 4 мин 40 с, а ширина пика на половине его высоты 34 с, длина колонки а) 3 м, б) 15 см. В каком случае реализован вариант высокоэффективной хроматографии?
 ,
,  ,
,
где H - высота, эквивалентная теоретической тарелке,R - время удерживания, ω1/2 - полуширина пика.
. Рассчитать молярную концентрацию эквивалента ионов меди в растворе, если при анализе 15 мл этого раствора высота полярографической волны восстановления Cu2+ (h) составила 20,00 мм, а после добавления 2,0 мл стандартного 0,0530 н. раствора хлорида меди (II) высота увеличилась до 24,3 мм.
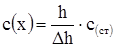 .
.
. Оптическое поглощение раствора окрашенного соединения железа, содержащего 1 мг/дм3 Fe3+ в монохроматическом свете в кювете с толщиной 3 см, равно 0,450. Определите молярное поглощение Fe3+ в этом соединении.
Ответ: 8400.
. Оптическое поглощение раствора вещества в кювете с l=3 см равно 0,750. Стандартный раствор, содержащий 5 мг/дм3 этого же вещества, имеет Аст=0,550 в кювете с l=5 см. Определите концентрацию раствора (в мг/дм3).
Ответ: 11,36 мг/дм3.
. Определите концентрацию рутина (витамина Р) (в моль/дм3 и мг/дм3), если оптическое поглощение анализируемого раствора А=0,780, а стандартного 6,1∙10-5 М раствора Аст=0,650 при 258 нм (Мрутина=610 г/моль).
Ответ: 7,32∙10-5 моль/дм3; 44,7 мг/дм3.
. При анализе салициловой кислоты (о-оксибензойная) на чистоту в тонком слое окиси алюминия в системе растворителей - петролейный эфир - этилацетат - уксусная кислота (85:10:5) и при проявлении в парах йода было получено два пятна с Rf, равным 0,63 и 0,72, и относительной интенсивностью 20:1. Определить, какое вещество и в каком количестве (в %) содержит салициловая кислота в виде примеси, если для данной системы имеем:
вещество - Rf
салициловая кислота - 0,63
эфир салициловой кислоты - 0,72
м-оксибензойная кислота - 0,82оксибензойная кислота - 0,90.
. Рассчитайте ОB потенциал редокс-пары IO3-,Н+/I- в водном растворе, для которого рН=2, а активности окисленной и восстановленной форм равны 1∙10-4 и 1∙10-2 моль/л соответственно. Стандартный ОB потенциал данной редокс-пары при комнатной температуре равен 1,08 В; число электронов, принимающих участие в ОB процессе, равно n=6.
Ответ: 0,94 B.
. Рассчитайте молярное поглощение окрашенного раствора Fe3+ с сульфосалициловой кислотой, содержащего 4∙10-3 г/дм3 Fe3+, если толщина слоя 2 см, а оптическое поглощение 0,56.
Ответ: 4∙103.
. Как изменится потенциал электрода, погруженного в раствор, содержащий хлорат-ионы ClO3- и хлорид-ионы Cl- при их одинаковых активностях, если рН этого раствора уменьшить от 5 до 1? Стандартный ОB потенциал редокс-пары ClO3-,H+/Cl- при комнатной температуре Е0=1,45 В; n=6.
Ответ: потенциал возрастет на 0,24 В.
. Вычислите концентрацию ионов серебра над осадком при 200С, если потенциал серебряного электрода, опущенного в раствор, равен 0,418 В по отношению к стандартному водородному электроду.
Ответ: 2,63∙10-7 моль/дм3.
. Определите концентрацию Cu2+ (в моль/дм3 и мг/дм3), если оптическое поглощение раствора аммиаката меди в кювете с l=2 см составляет 0,254, а молярное поглощение 423,3.
Ответ: 3∙10-4 моль/дм3; 19,2 мг/дм3.
. Вычислите реальный электродный потенциал медного электрода, опущенного в 0,02 н. раствор соли меди при 300С, относительно стандартного водородного электрода.
Ответ: +0,294 В.
. Вычислите ПРAgCl при 250С, если реальный электродный потенциал серебряного электрода, опущенного в насыщенный раствор AgCl, равен 0,518 В относительно водородного электрода.
Ответ: 1,69∙10-10.
. Величина пропускания стандартного раствора рибофлавина с концентрацией 5∙10-2 мг/мл при толщине кюветы 1 см составила 47,2%. Рассчитать концентрацию рибофлавина и его массу в 50 мл анализируемого раствора, если при его фотометрировании в тех же условиях получено Т=32,7%. Чему равны значения массового и молярного коэффициентов поглощения рибофлавина (М=376 г/молъ).
. Вычислите потенциал алюминиевого электрода в растворе, содержащем 13,35 г AlCl3 в 500 см3 раствора, при 300 С относительно водородного электрода.
Ответ: 1,656 В.
. Реальный ОВ потенциал редокс-пары Sn4+/Sn2+ при комнатной температуре равен 0,2 В. Рассчитайте, чему равно отношение активностей окисленной и восстановленной форм a(Sn4+)/a(Sn2+)в данном растворе. Стандартный ОВ потенциал указанной редокс-пары Е0=0,15 В.
Ответ: 50.
. Для стандартных растворов кофеина, теобромина, теофиллина рассчитали значения факторов удерживания: Rf кофеина = 0,873, Rf теобромина = 0,653, Rf теофиллина =0,461. Определить качественный состав анализируемой смеси, если на её хроматограмме растворитель прошел расстояние 4,5 см, а также имеются два пятна на расстоянии 3,93 и 2,1 см от линии старта.
. Рассчитать массу рутина (витамин Р, М=610 г/моль), которая содержится в 250 мл раствора, если оптическая плотность этого раствора при длине волны 258 нм и толщине кюветы 50 мм равна 0,780, а стандартного 6,1∙10-5 М раствора - 0,650. Чему равны значения молярного и массового коэффициентов поглощения рутина?
. При хроматографировании на бумаге величины Rf составили для фенобарбитала 0,5, для барбитала 0,7, для этаминала натрия 0,95. Какой из указанных барбитуратов присутствует в исследуемом растворе, если в тех же условиях при пробеге растворителя 12 см пятно оказалось на расстоянии 8,2 см от старта?
. Определите содержание Fe3+ (в мг/дм3), если оптическое поглощение раствора соли Fe3+ с сульфосалициловой кислотой в кювете толщиной 2 см равно 0,44. Оптическое поглощение стандартного раствора, содержащего 2 мг/дм3, равно 0,28.
Ответ: 3,14 мг/дм3.
. При каком значении рН водного раствора реальный ОB потенциал редокс-пары BrO3-,H+/Br- в кислой среде составляет Е=1,28 В при комнатной температуре, если активности окисленной и восстановленной форм одинаковы a(BrO3-)=а(Br-). Стандартный ОВ потенциал данной редокс-пары равен Е0=1,45 В; n=6.
Ответ: 2,88.
. Покажите, можно ли в стандартных состояниях веществ осуществить реакцию окисления хлорид-ионов Cl- ионами церия (IV). Стандартные ОВ потенциалы редокс-пар Се4+/Се3+ и Cl2/Cl- равны соответственно Е0=1,77 В и Е0=1,36 В.
Ответ: можно, т.к. ЭДС реакции положительна.
. Рассчитайте константу равновесия реакции
MnO4- + 5Br- + 8H+ = Mn2+ + 2,5Br2 +4H2O,
протекающей при комнатной температуре. Стандартные ОВ потенциалы редокс-пар MnO4-,H+/Mn2+ и Br2/Br- - равны соответственно 1,51 и 1,087 В.
Ответ: 7∙1035.
. Определите содержание меди (в %) в 10 г образца, 1 г которого растворили в мерной колбе вместимостью 100 см3. Оптическое поглощение полученного раствора в кювете с толщиной слоя 3 см составило 0,675, а ε =4,5∙104.
Ответ: 3,2∙10-3%.
. Оптическая плотность стандартного раствора рибофлавина с концентрацией 2,5∙10-2 мг/мл при толщине кюветы 1 см составила 0,324. Рассчитать концентрацию рибофлавина и его массу в 50 мл анализируемого раствора, если при его фотометрировании в тех же условиях получено значение А=0,486. Чему равны значения массового и молярного коэффициентов поглощения рибофлавина (М=376 г/моль).
. Рассчитайте константу равновесия К реакции Sn2++2Се4+=Sn4++2Ce3+, протекающей в водном растворе при комнатной температуре. Стандартные ОВ потенциалы редокс-пар Се4+/Ce3+ и Sn4+/Sn2+ при комнатной температуре соответственно равны 1,77 и 0,15 В.
Ответ: К=8,2∙1053.
. Оцените полноту окисления железа (II) при комнатной температуре двумя разными окислителями: раствором сульфата церия (IV) и раствором азотной кислоты HNO3. Стандартные ОВ потенциалы редокс-пар Се4+/Се3+; Fe3+/Fe2+ и NO3-,H+/NO равны соответственно 1,77, 0,77 и 0,96 В при комнатной температуре.
Ответ: К1/К2=8,9∙1016/4,6∙109=1,9∙107.
. Рассчитайте константу равновесия реакции 2I-+H2O2+2H+=I2+2H2O при комнатной температуре. Стандартные ОВ потенциалы редокс-пар I2/2I- и H2O2,H+/Н2O равны 0,621 и 1,77 В соответственно.
Ответ: 1039.
. При определении адипиновой кислоты в продукте гидрокарбоксилирования бутадиена методом бумажной хроматографии полученные пятна проявили метиловым красным, вырезали, высушили и взвесили. Для стандартных смесей с различным содержанием адипиновой кислоты получили данные:
| Масса кислоты, мкг | ||||
| Масса бумаги с пятном |
Навеску анализируемого образца массой 150 мг растворили в 20 мл воды и пробу полученного раствора 0,05 мл хроматографировали. Масса полученного пятна составила 107 мг. Определить массовую долю адипиновой кислоты в анализируемом продукте.
. Вычислите потенциал кадмиевого электрода в 0,05 н. Cd(NO3)2 относительно стандартного водородного электрода при 250С.
Ответ: 0,447 В.
. Рассчитайте реальный ОВ потенциал электрода, опущенного в раствор, в котором активности MnO4- и Mn2+ одинаковы, а рН=1. Стандартный ОВ потенциал редокс-пары MnO4-,H+/Mn2+ равен Е0=1,51 В при комнатной температуре.
Ответ: 1,42 В.
. Покажите, можно ли в стандартных состояниях веществ окислить хлорид-ионы Cl- перманганат-ионами MnO4- в кислой среде при комнатной температуре. Стандартные ОВ потенциалы редокс-пар MnO4-, H+/Mn2+ и Cl2/Cl- равны соответственно 1,51 и 1,36 В.
Ответ: можно, т.к. ε>0.
. Рассчитать массу рутина (витамин Р, М=610 г/моль), которая содержится в 250 мл раствора, если величина пропускания этого раствора при длине волны 256 нм и толщине кюветы 50 мм равна 16,6%, а стандартного 6,1∙10-5 М раствора - 28,2%. Чему равны значения молярного и массового коэффициентов поглощения рутина?
. Определите содержание Fe3+ (в мг/дм3), если оптическое поглощение его раствора с сульфосалициловой кислотой равно 0,45 в кювете толщиной 2 см, а ε=4∙103.
Ответ: 3,13 мг/дм3.
. Вычислите молярное поглощение раствора аммиаката меди (II), если оптическое поглощение его, содержащего 9,6 мг/дм3 Cu2+, в кювете толщиной 2 см равно 0,127.
Ответ: 423,3.
. Рассчитайте ОB потенциал редокс-пары Fe3+/Fe2+ при комнатной температуре при следующих условиях: а) активности окисленной и восстановленной форм равны: a(Fe3+)=a(Fe2+); б) отношение активностей а(Fe3+):a(Fe2+)=10; в) отношение активностей a(Fe3+):a(Fe2+)=0,1. Стандартный ОB потенциал данной редокс-пары при комнатной температуре равен Е0=0,771 В.
Ответ: 0,771; 0,830; 0,712 В.
. При хроматографировании на пластинках «Силуфол» и при использовании в качестве подвижной фазы смеси хлороформ-метанол (9:1) амидопирин, бутадион и димедрол имеют величины Rf, равные 0,60; 0,05; 0,95 соответственно. Какие из перечисленных лекарственных веществ содержатся в неизвестной смеси, если при ее хроматографировании в тех же условиях получены два пятна на расстоянии 4,8 см и 4 мм от стартовой линии, а растворитель прошел 8,0 см. Нарисовать вид хроматограммы.
. Для определения меди в препарате из навески его массой 0,325 г после растворения и обработки избытком аммиака было получено 250 мл окрашенного раствора, оптическая плотность которого в кювете с толщиной слоя 20 мм при длине волны = 620 нм равна 0,254. Рассчитать массовую долю меди в препарате, если молярный коэффициент поглощения аммиаката меди равен 423 моль-1∙л∙см-1.
. На пластинке силуфола после элюирования получили три пятна на расстоянии 24,37 и 49 мм. Растворитель «ушел» на 61 мм. Нарисовать хроматограмму, полученную на фотоденситометре.
. При хроматографировании на бумаге величины Rf составили для фенобарбитала 0,3, для барбитала 0,6, для этаминала натрия 0,85. Какой из указанных барбитуратов присутствует в растворе, если в тех же условиях при пробеге растворителя 14 см пятно оказалось на расстоянии 11,8 см от старта?
. Рассчитать массовую долю меди в препарате, если 1 г препарата растворили в мерной колбе вместимостью 100 мл в присутствии 8-оксихинолина, и оптическая плотность при длине волны 410 нм и толщине поглощающего слоя 30 мм составила 0,675. Молярный коэффициент поглощения комплекса меди с 8-оксихинолином равен 5,2∙103 моль-1∙л∙см-1.
. Определите ОВ потенциал редокс-пары BrO3-,H+/Br-, если концентрации c(BrO3-)=c(Br-)=c(H+)=0,01 моль/л, а стандартный ОВ потенциал этой редокс-пары при комнатной температуре Е0=1,45 В. ОВ-полуреакция может быть представлена в виде: BrO3- + 6H+ + 6ē = Br- + 3H2O.
Коэффициенты активности ионов принять равными единице.
Ответ: 1,33 В.