Тема III. Протолитические равновесия в растворах солей. Степень и константа гидролиза. Расчет рН в растворах гидролизующихся солей.
В водных растворах соли, содержащие катионы слабых оснований, и анионы слабых кислот подвергаются гидролизу, то есть взаимодействуют с протонами или гидроксильными группами нейтральных молекул воды. В растворах устанавливается гидролитическое равновесие, которое характеризуется константой гидролиза (Кh). При изучении этой темы необходимо обратить внимание на правильное написание уравнений реакций гидролиза в ионном виде и выражение константы гидролиза. Уметь выводить расчетные формулы степени гидролиза (h) и рН растворов гидролизующихся солей, знать факторы, влияющие на гидролиз.
Пример 1.Вычислить [H+] и pH 0,005 M NH4NO3, а также степень и константу гидролиза NH4NO3.
Решение: Составляем уравнение реакции гидролиза:
NH4+ + H2O = NH4OH + H+.
Рассчитываем концентрацию H+-ионов по формуле:
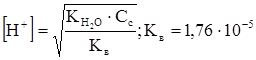 .
.
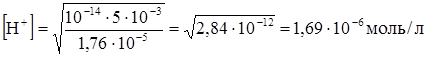

Степень гидролиза h рассчитываем по формуле: 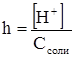
 .
.
Константу гидролиза Кг рассчитываем по формуле: 
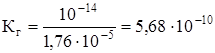 .
.