Решение.
Пишем уравнение реакции:
S2O32- + I2 = S4O62- + 2I-
I2 + 2ē → 2I-
S2O32- - 2ē → S4O62- + 2I-
1/z(S2O32-) = 1, 1/z(I2) = 1/2, 1/z(S4O62-) = 1/2.
В данной точке значение потенциала рассчитывают по системе 4O62-/2S2O32-,
так как она лежит до точки эквивалентности.
Согласно уравнению Нернста:

рассчитываем [S4O62-] и [S2O32-]:
Было S2O32- 0,1∙50=5 ммоль-экв
Добавлено I2 0,2∙20=4 ммоль-экв
Осталось S2O32- 5-4=1 ммоль-экв
Образовалось S4O62- 4 ммоль-экв.
Так как в уравнении Нернста входят молярные концентрации ионов, число ммоль S4O62- = 1/2∙4 = 2 ммоль.
 моль/л
моль/л
 моль/л
моль/л
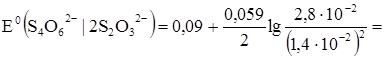

При проведении количественных расчетов следует особое внимание обратить на окислительно-восстановительную реакцию, протекающую в процессе титрования. Решая конкретную задачу, обязательно пишут уравнение реакции и по ней определяют фактор эквивалентности. В данном методе помимо методов прямого и обратного титрования часто используют метод косвенного титрования (метод замещения).