рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Вид работы: Лабораторные Работы
- /
- По курсу "Химия" для студентов нехимических специальностей
Реферат Курсовая Конспект
По курсу "Химия" для студентов нехимических специальностей
По курсу "Химия" для студентов нехимических специальностей - Лабораторная Работа, раздел Химия, Министерство Образования Российской Федерации ...
| Министерство образования Российской Федерации | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тверской государственный технический университет | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кафедра биотехнологии и химии | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Лабораторные работы по химии | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Учебно-методическое пособие к выполнению лабораторных работ по курсу "Химия" для студентов нехимических специальностей | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тверь 2002 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Методическое пособие содержит правила оформления лабораторных работ, а также теоретические сведения по основным разделам курса «Химия». Указания предназначены для самостоятельной подготовки студентов к лабораторным работам по курсу «Химия». Методическая разработка обсуждена и рекомендована к печати на заседании кафедры биотехнологии и химии ТГТУ (протокол № 5 от 04 февраля 2002 г.). | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Лабораторные работы по химии | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Учебно-методическое пособие по выполнению лабораторных работ по курсу "Химия" для студентов нехимических специальностей | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Составители: М.М. Усанова, Э.М.Сульман, М.А. Крупцова, В.Г. Матвеева, М.Е. Веселова. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Редактор Т.С. Синицына | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Технический редактор Г.В. Комарова | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
________________________________________________________________
________________________________________________________________
Тверь. Типография ТГТУÓ Тверской государственный технический университет, 2002Общие правила работы в лаборатории1. Для успешной работы и лучшего усвоения темы необходима предварительная подготовка к лабораторной работе. Перед каждым занятием студент должен… 2. Не разрешается входить в лабораторию в верхней одежде и категорически… 3. Для работы в лаборатории студенту отводится постоянное рабочее место, которое следует содержать в чистоте и…Реактивы и правила обращения с реактивами1. По степени чистоты реактивы делятся на технические (техн.), чистые (ч.), чистые для анализа (ч.д.а.), химически чистые (х.ч.). 2. Необходимые для работы реактивы выставляются на рабочий стол или на полки… 3. Реактивы общего пользования, в том числе реактивы, хранящиеся в вытяжном шкафу, не следует уносить к себе на…Меры предосторожности при работе в лаборатории2. Опыты с ядовитыми и неприятно пахнущими веществами следует проводить в вытяжном шкафу. 3. Опыты с легко воспламеняющимися веществами необходимо проводить вдали от… 4. При разбавлении концентрированных кислот, особенно серной, следует вливать небольшими порциями кислоту в воду,а не…Оказание первой помощи1. При попадании на кожу концентрированных кислотследует тотчас же смыть ее большим количеством воды из крана, а затем обработать пораженный… 2. При попадании на кожу щелочи надо тщательно промыть водой до прекращения… 3. При термических ожогах на пораженный участок накладывают повязку, пропитанную 2%-м раствором перманганата калия…Лабораторная работа №1 ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ МАССЫ ЭКВИВАЛЕНТА ЦИНКА (Глинка Н.Л.,2000, 1.1-1.5, Коровин Н.В., 2000, §§1 - 3)
Цель занятия: научиться вычислять молярную массу эквивалента вещества и определять ее экспериментально.
Теоретические сведения Единицей количества вещества является моль. Моль – это количество вещества, которое содержит столько структурных единиц (молекул, атомов, ионов, катионов, электронов, эквивалентов и т.д.), сколько атомов содержится в 12 г изотопа углерода –12, а именно, 6,02.1023 (число Авогадро). Эквивалентом элемента или вещества называется такое его количество, которое соединяется с одним молем атомов водорода или замещает один моль водорода в химических реакциях. Массу одного моля эквивалентов называют молярной массой эквивалентов вещества (Мэ), г/моль. Пример. В веществах HCl, H2O, NH3 с одним моль атомов водорода связан один моль атомов Cl, 1/2 моль кислорода и 1/3 моль азота, следовательно, эквиваленты этих элементов в указанных соединениях соответственно равны 1, 1/2 и 1/3 моль (1, ½, ⅓ – фактор эквивалентности). В рассмотренном примере молярная масса эквивалента Мэ(Н) = 1 г/моль, Мэ(О) = 8 г/моль, Мэ(N) = 4,6 г/моль. Молярная масса эквивалента элемента в соединении не является величиной постоянной, зависит от валентности элемента в данном соединении и выражается уравнением
где М – молярная масса элемента, г/моль; Z – валентность элемента в данном соединении; 1/z – фактор эквивалентности. Молярные массы эквивалентов сложных соединений рассчитываются по формулам где n – число атомов кислорода; Z – валентность кислорода
где основность кислоты – это общее число атомов водорода или число атомов водорода, замещенных в реакции атомами металла. Например, основность фосфорной кислоты в реакции
H3PO4 + 2 NaOH = Na2HPO4 + 2 H2O равна 2, т.к. 2 атома водорода заместилось атомами натрия.
где кислотность основания – это общее число OH- - групп или число OH- - групп, замещенных в процессе реакции кислотными остатками. Например, кислотность гидроксида алюминия в реакции Аl(ОН)3 + 2 НС1 = А1(OH)С12 + 2 H2O равна 2, т.к. 2 группы OH- заместились двумя хлорид-ионами (Cl-).
где n – число атомов металла; Z – валентность металла. Согласно закону эквивалентов массы (объемы) всех веществ, реагирующих между собой в химических реакциях, прямо пропорциональны их молярным массам эквивалентов (молярным объемам эквивалентов)
где m1 и m2 – масса веществ, вступивших или получившихся в результате реакции, г; Mэ1, Мэ2 – молярные массы эквивалентов этих веществ, г/моль; V1, V2-объемы газообразных веществ при н.у.; V10 и V20 - объем, который занимает эквивалент вещества при н.у. Молярный объем эквивалента вещества Vэо – это объем, занимаемый одним моль эквивалентом газообразного вещества, при нормальных условиях. Газовые законы и расчет молярных масс газообразных веществ Уравнение Бойля-Мариотта и Гей-Люссакагде V – объем газа, измеренный при реальных условиях, т.е. при атмосферном давлении Р и температуре Т; V0 – объем газа при нормальном давлении Р0 и… 2. Закон Авогадро:в равных объемах разных газов при одинаковом давлении и… При нормальных условиях (T= 273К, p = 101,325 кПа или 760 мм рт.ст.) моль любого газа занимает объем 22,4 л. Теперь…Молярную массу газа можно вычислить, пользуясь уравнением Клапейрона - Менделеевагде Р – давление, кПа; V – объем, л; m- масса, г; М – молярная масса, г/моль; R – универсальная газовая постоянная, равная 8,314 Дж/(моль . К); Т –… 4.Из закона Авогадро следует, что при одном и том же давлении и температуре… , или D =Закон Дальтона (закон парциальных давлений). Парциальным давлением (po) газа в смеси называется давление, которое производил бы этот газ, занимая при тех же физических условиях объем всей газовой смеси. Согласно закону: общее давление смеси газов, не вступающих друг с другом в химическое взаимодействие, равно сумме парциальных давлений газов, составляющих смесь.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ.Оборудование: эвдиометр, штатив, колба, соединительные трубки, кристаллизатор, термометр, барометр, соляная кислота (HCl 1:2), таблетка цинка. Метод основан на измерении объема водорода, который выделяется из кислоты при действии на нее металла.РАСЧЕТ МОЛЯРНОЙ МАССЫ ЭКВИВАЛЕНТА ЦИНКА.Þ V0(H2) = где - давление водорода, кПа; То – абсолютная температура, 273 К; Ро – давление при н.у., кПа (760 мм рт.ст. = 101,325…СПОСОБЫ ВЫРАЖЕНИЯ СОДЕРЖАНИЯ РАСТВОРЕННОГО ВЕЩЕСТВА В РАСТВОРЕ (Глинка Н.Л., 2000, 7.2.2, Коровин Н.В., 2000, §4.1) Цель занятия: изучить методику приготовления растворов, экспериментально определить плотности растворов.
Теоретические сведения Раствор –гомогенная система состоящая из двух или нескольких компонентов. Чаще раствор состоит из двух компонентов растворителя и растворенного вещества. Отношение количества или массы вещества, содержащегося в системе (например, в растворе), к объему или массе этой системы называют концентрацией. Известно несколько способов выражения концентрации. Молярная концентрация (СМ)илимолярность –этоотношение количества растворенного вещества (n), содержащегося в растворе, к объему (V) этого раствора. Единица измерения – моль/л. CM = Раствор, имеющий концентрацию 1 моль/л, называют молярным раствором и обозначают 1М раствор; соответственно, раствор, имеющий концентрацию 0,5 моль/л, обозначают 0,5 М. Нормальная (эквивалентная) концентрация (СН)или нормальность – это отношение количества эквивалентов растворенного вещества к объему раствора. Единица измерения – моль-экв./л
Раствор, в 1 литре которого содержится 1 моль-эквивалент вещества, называют нормальным и обозначают 1 н. Соответственно, могут быть 1 н., 0,01 н. и т.п. растворы. Моляльная концентрация (Сm)или моляльность - этоотношение количества растворенного вещества к массе (m) растворителя. Единица измерения – моль/кг.
Массовая доля (ω)- отношение массы растворенного вещества к общей массе всего раствора. Массовая доля может быть выражена в долях единицы, процентах (%).
Массовая доля, выраженная в процентах, показывает, сколько граммов растворенного вещества содержится в 100 граммах раствора. Пример: запись 35% раствор HCl означает, что в 100 г раствора содержится 35 г растворенного вещества (HCl) и 65 г растворителя (воды). Мольная доля (N) –это отношение количества растворенного вещества к общему сумме количеств растворенного вещества и растворителя.
Титр раствора (Т) – это масса вещества, содержащегося в 1 см3 или в 1 мл раствора. Единица измерения титра – г/см3, г/мл.
ПРАВИЛО СМЕШИВАНИЯ (ПРАВИЛО «КРЕСТА») Применяют для быстрого расчета масс или объемов при приготовлении раствора из двух растворов различной концентрации Задача: Рассчитать и приготовить 3 кг 30% раствора H2SO4 из 98% раствора H2SO4 (ρ=1,86 г/мл) и воды. Рассчитать объем 98% раствора и объем воды необходимые для приготовления заданного раствора. Составляем крест
H2O 0 %
В левый столбик записываем исходные растворы и их процентные концентрации, причем процентная концентрация воды равна 0%. Далее между ними посередине записываем ту концентрацию, которую необходимо приготовить, и по направлению стрелок вычитаем из большего значения меньшее и по диагонали записываем полученное число. В правой части получили весовые соотношения двух исходных растворов. Общая масса полученного 30%-го раствора равна сумме 30 г 98% H2SO4 + 68 г H2O = 98 г. Для приготовления 98 г (30%) р-ра необходимо взять 30 г H2SO4 (98%) и добавить 68 г воды. Затем находим массу m 98% р-ра H2SO4, необходимую для приготовления 3 кг 30 % р-ра H2SO4. Составляем пропорцию: 1) Для приготовления 98 г (30%) нужно взять - 30 г (98%) р-ра H2SO4 3000 г (30%) - X г
X = Рассчитываем объем: 2)
Итак, для приготовления 3 кг 30% р-ра H2SO4 нужно отмерить 2,08 л дистиллированной воды и добавить 0,495 л 98% H2SO4.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ Опыт №1. Приготовление раствора заданной концентрации.№ п.п Опыт №1 Опыт №2 50 г 5% р-ра CuSO4 55 г 4% р-ра K2Cr2O7 53 г 4,5%… Ход работы:Опыт №2.Домашнее задание: Рассчитать все виды концентрации: См, Сm, Сн, Nр.в-ва и Nр-ля. Данные взять из…Лабораторная работа № 3 ОПРЕДЕЛЕНИЕ ЭНТАЛЬПИИ РЕАКЦИИ НЕЙТРАЛИЗАЦИИ (Глинка Н.Л.,2000, 6.1, Коровин Н.В., 2000, §§ 5.1 – 5.4)
Цель занятия: выполнить калориметрические измерения и термодинамические расчеты, связанные с энергетикой химических процессов. Теоретические сведенияХимический процесс, фазовые превращения сопровождаются энергетическими изменениями. Законы взаимного превращения различных видов энергии, а также… Химическая термодинамика базируется на законах. I закон термодинамики:Теплота, сообщенная системе расходуется на изменение внутренней энергии D U и работы расширения…Q = DU + A, A = p DV Q = DU + p DV Внутренняя энергия U – это функция состояния системы, включающая энергию движения атомов и молекул, электронов и ядер в атомах, внутриядерную энергию, энергию межмолекулярного взаимодействия и другие виды энергий, за исключением кинетической и потенциальной энергии системы, как целого. Абсолютную величину запаса внутренней энергии химической системы измерить невозможно. Определяют изменение внутренней энергии системы при переходе её из начального в конечное состояние (из исходных веществ в продукты реакции) DU = Uк – Uн Если процесс идёт с поглощением тепла, внутренняя энергия возрастает, если с выделением, то уменьшается. В изобарном процессе (p = const), U + pV = H – функция состояния, называемая энтальпия(теплосодержание). Qp = DH В изохорном процессе (V = const) QV = DU. Раздел термодинамики, изучающий тепловые эффекты называется термохимией. Тепловым эффектом реакции Q называется количество тепла, поглощаемое или выделяемое в процессе химической реакции (кДж). Если процесс идет с выделением тепла (экзотермический), тепловой эффект условно берется со знаком плюс (+Q), если тепло поглощается (эндотермический процесс) – со знаком минус (–Q). При записи термохимических уравнений реакции указывается тепловой эффект с соответствующим знаком, агрегатное состояние вещества; допускаются дробные коэффициенты H2(г) + 1/2 О2(г) = Н2О(ж) + 285,8 кДж/моль. Стандартной теплотой образования (DНо298) называется тепловой эффект образования 1 моль сложного вещества из простых веществ, находящихся в устойчивом агрегатном состоянии при стандартных условиях Tо = 25 оC (298 K) ; P = 101,3 кПа. Стандартные энтальпии образования простых веществ принимают равными нулю: DНоСа(к) = 0 ; DНоО2(г)= 0. Для экзотермических процессов DH < 0, для эндотермических – DH > 0. Основными законами термохимии являются: 1. Закон Лавуазье-Лапласа: энтальпия разложения сложного вещества равна по абсолютной величине, но противоположна по закону энтальпии образования этого вещества из продуктов разложения DНразл = – DНобр. 2. Закон Гесса: тепловой эффект реакции, протекающий при постоянных давлении и температуре, не зависит от пути протекания процесса, а зависит только от начального и конечного состояния веществ. Для расчётов удобно пользоваться следствием из закона Гесса: тепловой эффект химической реакции равен алгебраической сумме теплот образования продуктов реакции за вычетом алгебраической суммы теплот образования исходных веществ, с учётом стехиометрических коэффициентов. DНх.р=S nDНобр. прод – S nDНобр. исх. вещ-в Пример: СН4(г) + 2О2(г) = 2Н2О (ж) + СО2 (г) D Нох.р = D Нообр СО2 (г) + 2D Нообр Н2О (ж) – D Нообр СН4 (г)
Большинство химических процессов протекают самопроизвольно в сторону уменьшения запаса внутренней энергии или энтальпии системы. Но известны и такие процессы, которые протекают самопроизвольно без изменения внутренней энергии системы, движущей силой таких процессов является энтропия S системы. Энтропия характеризует беспорядок в системе, чем выше беспорядок, тем выше энтропия. В изолированных от внешней среды системах процессы протекают самопроизвольно в направлении увеличения энтропии (DSх.р >0). Энтропия реакции рассчитывается по следствию из закона Гесса и имеет единицу измерения Дж/моль.К. DSх.р= SnSoобр. прод. – SnSoобр. исх. вещ-в Таким образом, существуют два основных фактора самопроизвольного протекания процессов: 1) уменьшение внутренней энергии или энтальпии системы (DU<0; DН<0); 2) увеличение беспорядка или энтропии системы (DS > 0). В термодинамике существует функция, которая отражает влияние на направление процесса двух рассмотренных факторов одновременно. Такой функцией для процессов, протекающих при постоянной температуре и давлении, является изобарно-изотермический потенциал G (или энергия Гиббса, свободная энергия системы, кДж). Изменение изобарно-изотермического потенциала химической реакции можно рассчитать по формуле Гиббса DGх.р= DНх.р– Т DSх.р, где Т – абсолютная температура процесса. DG х.р характеризует общую движущую силу процесса. Если процесс протекает в стандартных условиях, то DGох.р рассчитывается также по следствию из закона Гесса. Величина и знак DGх.р характеризуют принципиальную возможность протекания химического процесса. Если DGх.р<0, процесс протекает самопроизвольно при данных условиях.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Задание. Определить теплоту нейтрализации сильной кислоты сильным основанием и рассчитать энергию Гиббса данной реакции. Согласно теории электролитической диссоциации нейтрализация сильной кислоты сильным основанием в разбавленном растворе отвечает ионно-молекулярному уравнению Н+ + ОН- = Н2О. H2SO4 + NaOH = NaHSO4 + H2O Для проведения реакции используют калориметрическую установку (рис.2).
Во внутренний стакан калориметра налить 50 мл 1 н. раствора щёлочи замерив объём раствора цилиндром. Измерить температуру раствора щёлочи с точностью до 0,1 оС. В другой мерный цилиндр налить такой же объём 1 н. раствора кислоты. Быстро влить кислоту в калориметрический стакан и перемешивая раствор мешалкой замерять изменение температуры через каждые 30 секунд в течение 4,5 минут. Показания термометра определять с точностью до 0,1ОС. Данные опыта занести в табл. 2. Таблица 2 Результаты опытаПостроить график зависимости t,ОС - τ, мин. На рис.3 приведен примерный вид этого графика. Рис.3. График зависимости температуры от…Таблица 3 Значение термодинамических функций
ОФОРМЛЕНИЕ РАБОТЫ: 1. Рассчитать количество теплоты q, кДж, выделившейся при реакции q = ( tк – tн) mC,
где m- масса воды, m = 0.1 кг (50 г кислоты + 50 г щелочи), а С - удельная теплоемкость, С= 4.2 кДж/моль. К 2. Рассчитываем число моль воды, учитывая, что 1 моль щёлочи идет на образование 1 моль воды, а СН (кислоты) = СН (щелочи) = 1 моль-экв./л
n (Н2О) = 3. Рассчитать энтальпию реакции нейтрализации ΔHo на 1 моль кислоты кДж/моль q, кДж - 0.05 моль ΔHo, кДж - 1 моль
5. Теоретическое изменение энтальпии реакции нейтрализации, кДж/моль
6. Ошибку %, в опыте по формуле % ошибки = 7. Изменение энтропии реакции нейтрализации, D Sох.р; [Дж/моль . К], для чего использовать данные табл. 3, уравнение реакции и следствие из закона Гесса. 8. Изменение энергии Гиббса реакции нейтрализации по формуле DGx.p= где T – начальная температура, К. 9. Сделать вывод о соответствии найденной величины и знака DGx.p самопроизвольному течению проделанной вами реакции нейтрализации. _______________________________________________________ *) Описанным способом можно определить энтальпию нейтрализации только сильных кислот сильными основаниями в разбавленных растворах, так как она не зависит от их природы, и взаимодействие определяется реакцией H+ + OH- = H2O (ж) ; ΔHo298 = - 55.6 кДж/моль При нейтрализации слабых кислот и слабых оснований энтальпия нейтрализации меньше, так как при ионизации кислоты и основания затрачивается энергия.
Лабораторная работа №4 ХИМИЧЕСКАЯ КИНЕТИКА (Глинка Н.Л., 2000, 6.2.1-6.2.6., Коровин Н.В., 2000, глава 7) Цель работы: изучение скорости химической реакции и ее зависимости от: концентрации реагирующих веществ, величины поверхности раздела реагирующих веществ, катализатора, температуры. Теоретические сведения. Скоростью химической реакции называют изменение концентрации реагирующего вещества в единицу времени в единице реакционного пространства. Скорость реакции определяется природой реагирующих веществ и зависит от условий протекания процесса (концентрации, температуры, наличия катализатора и др.). Зависимость скорости реакции от концентрации выражается основным постулатом химической кинетики, законом действующих масс:при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам. Например, для реакции
3H2(г) + N2(г) → 2NH3(г) Закон действующих масс может быть записангде W- скорость химической реакции; k – константа скорости; Си С- концентрации реагирующих веществ. Уравнение (1) называется кинетическим. Реакции в гетерогенной системе осуществляются на поверхности раздела фаз.… C(к) + O2(г) → CO2 (г)Закон действующих масс имеет видгде W- скорость химической реакции; k – константа скорости; С- концентрация кислорода; S – площадь поверхности раздела между фазами. Зависимость скорости от температуры выражается правилом Вант-ГоффаОпыт 1. Влияние концентрации реагирующих веществ на скорость химической реакции. Зависимость скорости химической реакции от концентрации реагирующих веществ изучают на примере взаимодействия тиосульфата натрия с серной кислотой. Na2S2O3+ H2SO4 = Na2SO4 + SO2 + S↓ + H2O Признаком реакции является помутнение (опалесценция) раствора вследствие выделения серы.
Выполнение работы. (Опыты проводить в сухих пробирках!)
Контрольный опыт: в пробирке смешать 10 капель 1н. Na2S2O3 и 2 капли 2н. H2SO4. Отметьте появление помутнения раствора. 1. Приготовить в трех пробирках три раствора Na2S2O3 различной концентрации, как указано в таблице. 2. Добавить одну каплю 2 н. раствора H2SO4 в первую пробирку и замерить по секундомеру время появления заметной опалесценции. 3. Тоже проделать со второй и третьей пробиркой. 4. Данные занести в таблицу. 5. Рассчитать скорость химической реакции W.
Оформление работы: 1. На основе экспериментальных данных опыта построить график зависимости скорости химической реакции от молярной концентрации реагирующих веществ (W- CM). Масштаб: максимальное значение W – 10 клеток CM=1 моль/л - 4 клетки 2. Почему прямая проходит через ноль? 3. Запишите кинетическое уравнение скорости прямой реакции 4. Сделайте вывод: как влияет СМ реагирующих веществ на скорость химической реакции? Опыт №2. Влияние величины поверхности раздела реагирующих веществ на скорость химической реакции в гетерогенной системе.
Данную зависимость изучают на примере растворения CaCO3 в HCl. Выполнение работы: в одну пробирку поместите ½ шпателя порошка мела CaCO3, а в другую – кусочек CaCO3 такой же массы. В обе пробирки одновременно добавьте по 10 капель концентрированной HCl. Замерьте время полного растворения CaCO3 в двух пробирках.
Запись данных опыта:
1. Напишите уравнение протекающей реакции. 2. Почему скорость растворения мела в пробирках различна? 3. Сделайте вывод. Опыт №3. Влияние катализатора на скорость химической реакции.
Влияние катализатора на скорость химической реакции изучают на примере каталитического разложения перекиси водорода.
Выполнение работы : в пробирку налить 1 мл 10% раствора H2O2. Добавить на кончике шпателя двуокись марганца MnO2.
Запись данных опыта: 1. Запишите уравнение разложения перекиси водорода и уравняйте. H2O2 O2 + H2O 2. Происходит ли разложение перекиси водорода в обычных условиях? 3. Какую роль играет MnO2? 4. Сделайте вывод.
Опыт №4. Влияние температуры на скорость химической реакции в гомогенной системе.Для выполнения опыта используется термостат – стакан с крышкой, в котором имеются три отверстия для термометра и двух пробирок. Выполнение работы: три термостата наполнить на 2/3 водой, температура которых… В каждый термостат вставить термометр и 2 пробирки. В первую пробирку налить 10 капель 1 н. раствора Na2S2O3, во…Лабораторная работа №5 ХИМИЧЕСКОЕ РАВНОВЕСИЕ (Глинка Н.Л., 2000, 6.2.8-6.2.9, Коровин Н.В., 2000, §5.5) Цель работы: опытным путем установить влияние на состояние химического равновесия: - изменения концентрации веществ; - изменения температуры. Теоретические сведения.Химическое равновесие характеризуется постоянством величин энергии Гиббса системы GT. Равенство ΔGT = 0 является термодинамическим условием… Химическое равновесие характеризуется постоянным для данных условий… Величина, равная отношению произведения равновесных концентраций продуктов реакции к произведению равновесных…ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ Опыт 1. Влияние изменения концентрации веществ на химическое равновесие.Роданид железа (III) Fe(SCN)3 придает раствору ярко красную окраску, раствор хлорида железа(III) окрашен в желтый цвет, а растворы роданида и… Выполнение опыта.Лабораторная работа №6 ОПРЕДЕЛЕНИЕ МОЛЕКУЛЯРНОЙ МАССЫ РАСТВОРЕННОГО ВЕЩЕСТВА МЕТОДОМ КРИОСКОПИИ.Цель работы: определить методом криоскопии молекулярную массу растворенного…ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬЗаданные растворы: С1 = 5%, C2 = 6%, C3 = 7% Рис.4. Схема установки … Ход работы: 1. Приготовить 10 г заданного раствора.Возможные виды криоскопических кривых
Лабораторная работа №7 КОЛЛОИДНЫЕ РАСТВОРЫЦель работы:знакомство с методами получения коллоидных растворов и их…ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Опыт 1. Образование геля кремниевой кислоты Na2SiO3 + 2HCl = H2SiO3 + 2NaCl Выполнение работы: а) Получение золя кремниевой кислоты В пробирку внесите 6 капель 2 н раствора соляной кислоты и добавьте, встряхивая пробирку, 15 капель 10%-го раствора силиката натрия. Образуется золь кремниевой кислоты, который постепенно застудневает с образованием геля. б) Коагуляция гидрозолей при нагревании Нагрейте полученный золь кремниевой кислоты. Наблюдайте образование студенистой массы, не выливающейся при перевертывании пробирки вверх дном - геля кремниевой кислоты. Запись данных опыта. Чем объясняется образование студней и в каких случаях это явление имеет место? Что такое гель? Объясните схему процесса образования геля, его структуру. Почему нагревание способствует коагуляции золей? Составьте формулу мицеллы золя кремниевой кислоты. Объясните механизм образования геля.
Опыт 2. Получение гидрозоля берлинской лазури методом пептизации. Для получения данного золя используется реакция обмена FeCl3 + 3K4[Fe(CN)6] = Fe4[Fe(CN)6]3 + 12KCl
Выполнение работы: а) Получение осадка берлинской лазури. Сливают в пробирке приблизительно 1 мл 0,05 М раствора FeCl3 и 1 мл насыщенного раствора K4[Fe(CN)6], полученный осадок берлинской лазури отфильтровывают и промывают на фильтре дистиллированной водой до удаления избытка K4[Fe(CN)6]. б) Пептизация осадка берлинской лазури. К оставшемуся на фильтре промытому осадку добавляют 2-3 мл раствора щавелевой кислоты. Фильтрат собирают в пробирку. Запись данных опыта. Сформулируйте сущность метода получения гидрозоля. Каким образом исходная концентрация влияет на получение коллоидных систем? Какой процесс называется пептизацией? Что является пептизатором в данном опыте? Опыт 3. Получение гидрозолей берлинской лазури с разноименными зарядами частиц Для получения данных золей используется реакция обмена FeCl3 + 3K4[Fe(CN)6] = Fe4[Fe(CN)6]3 + 12KCl
В результате реакции образуется золь мало растворимого в воде вещества Fe4[Fe(CN)6]3 - берлинской лазури. Реактивы: в работе используются 0,005 н раствор FeCl3 и 0,005 н раствор гексацианоферрата (II) калия K4[Fe(CN)6].
3.1 Приготовление золя берлинской лазури при избытке FeCl3
К 3 мл раствора FeCl3 прилейте 1 мл раствора K4[Fe(CN)6], перемешайте раствор. Образуется золь берлинской лазури. Что собой представляет золь? Укажите фазовый состав полученного золя. Составьте формулу мицеллы и укажите знак заряда гранулы.
3.2 Приготовление золя берлинской лазури при избытке K4[Fe(CN)6] К 3 мл раствора K4[Fe(CN)6] прилейте 1 мл раствора FeCl3. Определите фазовый состав полученного золя, заряд частиц золя. Составьте формулу мицеллы. Запись данных опыта. 1) Что такое золь? 2) Какие вещества могут образовывать золи в водной среде (гидрозоли) и при каких условиях? 3) Чем определяется знак заряда частиц золя? 4) Какие химические реакции предшествуют образованию мицелл? 5) Какие электролиты являются стабилизаторами 1-го и 2-го золей? 6) Каков ионный состав интермицеллярной жидкости при получении 1-го и 2-го золей? 7) Напишите возможные формулы мицелл, используя правило Фаянса-Панета.
3.3 Определение знака заряда частиц золя В окрашенных золях знак заряда частиц можно определить методом капиллярного анализа. Он основан на том, что целлюлозные стенки капилляров фильтровальной бумаги заряжены отрицательно, а пропитывающая бумагу вода - положительно. Если нанести на фильтровальную бумагу золь с отрицательным зарядом частиц, то он не адсорбируется бумагой и на ней образуется равномерно окрашенное пятно. Если частицы золя заряжены положительно, то они адсорбируются отрицательно заряженными стенками капилляров и на бумаге образуется пятно, окрашенное в центре и бесцветное по краям. Методом капиллярного анализа определите знаки заряда частиц полученных ранее золей берлинской лазури (опыт 1). Совпадают ли результаты анализа со знаками зарядов частиц, которые записаны в формулах мицелл (опыт 1)? Результаты опыта запишите в таблицу:
Опыт №4. Определение порога коагуляции золя гидроксида железа.Выполнение работы: 1. Подготовить 3 серии пробирок по 4 пробирки в каждой. 2. Налить в 4 пробирки соответствующие количества дистиллированной воды и раствора электролита (см.табл.) и добавить…СВОЙСТВА РАСТВОРОВ ЭЛЕКТРОЛИТОВ (Глинка Н.Л.,2000, 8.1-8.12, Коровин Н.В., 2000, §§ 8.3 – 8.6) Теоретические сведения.Для количественной характеристики электролитической диссоциации вводится понятие степени диссоциации α она показывает отношение числа молекул,…A = n / N Все электролиты делят на сильные и слабые.Это вещества, которые при растворении в воде практически полностью распадаются на ионы. Как правило, к сильным электролитам относятся вещества с… В растворе сильного электролита растворённое вещество находится в основном в… Слабые электролитыИзменение окраски кислотно-основных индикаторов В зависимости от pH раствораДля более точного определения значения pH растворов используют сложную смесь… 2. Электрохимический метод. Этот метод позволяет более точно определять значение рН среды. Он основан на измерении…Pb2+ + HOH →PbOH+ + H+ pH<7 – среда кислая Na2HPO4 + H2O « NaH2PO4 + NaOH PO43- + HOH → HPO42- + OH- pH>7 – среда щелочнаяAl2S3 + 6H2O « 2Al(OH)3¯ + 3H2S↑ Причиной гидролиза является взаимодействие ионов соли с молекулами воды с… Способность солей подвергаться гидролизу зависит от двух факторов:Опыт №1. Определение рН водных растворов электролитов.Цель работы: определение водородного показателя среды методами визуального колориметрирования и рН-метрии. № п/п …Опыт №2. Ионно-обменные реакции.
Работа с таблицей растворимости. А) Получение осадков соли. Ход работы: в пробирку накапать 3 капли растворимой соли (SnCl2, AlCl3, Cr2(SO4)3, ZnSO4, Pb(NO3)2 и т.д.) и добавить 1 каплю другого растворимого вещества (выбрать самостоятельно), чтобы в результате реакции образовалась нерастворимая соль. Написать уравнения реакции в молекулярной, ионно-молекулярной и ионной формах.
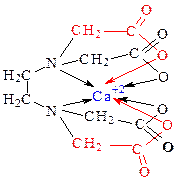
Б) Получение амфотерного гидроксида и исследование его свойств.Затем в первую пробирку добавьте кислоту до полного растворения осадка (кислоту выбрать по таблице растворимости). Напишите уравнения реакции в… Во вторую пробирку добавьте избыток NaOH до полного растворения осадка.…Опыт №3. Гидролиз солей.а) Реакция cреды в растворах различных солей. Задание:Б) Влияние температуры на равновесие гидролиза соли.Ход работы: В пробирку наполовину объема налейте 1 н раствор ацетата натрия и…Смещение равновесия гидролиза при изменении температурыСделайте вывод о влиянии температуры на степень гидролиза соли. Определите,…ОПРЕДЕЛЕНИЕ ОБЩЕЙ ЖЕСТКОСТИ ВОДЫ МЕТОДОМ КОМПЛЕКСОНОМЕТРИЧЕСКОГО ТИТРОВАНИЯ (Глинка Н.Л.,2000, глава 37, Коровин Н.В., 2000, §12.3) Теоретические сведения. Жесткость воды обусловлена содержанием в ней растворимых солей кальция и магния, гидрокарбонатов, хлоридов и сульфатов. Различают временную и постоянную жесткость воды. Временная жесткость определяется содержанием в воде растворимых гидрокарбонатов кальция и магния. При кипячении воды гидрокарбонаты переходят в малорастворимые карбонаты: Ca(HCO3)2 = CaCO3 ¯ + CO2 + H2O Mg(HCO3)2 = Mg(OH)2¯ + 2CO2 Карбонатную жесткость также можно удалить химическими способами, например, известкованием: Ca(HCO3)2 + Ca(OH)2 = CaCO3 ¯+ 2H2O Таким образом временная жесткость устраняется. Постоянная (некарбонатная) жесткость обусловлена присутствием в воде хлоридов и сульфатов кальция и магния. Некарбонатную жесткость можно удалить химическими способами: CaCl2 + Na2CO3 = CaCO3 Сумма временной и постоянной жесткости составляет общую жесткость. Выражается жесткость в миллимоль эквивалентных ионов Ca+2 и Mg+2 на литр воды. Вода с жесткостью менее 4 ммоль-экв/л называется мягкой, от 4 до 8 - средней и от 8 до 12 - жесткой. В настоящее время жесткость воды определяют комплексонометрическим методом с применением реактива Na2H2Y.2H2O двунатриевой соли ЭДТА (этилендиаминтетрауксусной кислоты) - Комплексона III или Трилона Б.
Реакция взаимодействия катиона с ЭДТА в растворе можно представить уравнением Ca+2 + H2Y2- = 2H+ + CaY2- где Y2- - анион ЭДТА. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ Порядок выполнения работы2. Взять пипеткой пробу воды 50 мл и поместить в коническую колбу. Добавить в воду 1 мл аммиачного буферного раствора (NH4OH + NH4Cl), для… 3. Титровать воду раствором Трилона Б до изменения окраски с… 4. Результаты титрования занести в таблицу:Ж = Сн. 1000 ммоль- экв/л H2O 6. Зарисовать бюретку, пипетку и коническую колбу. 7.Сделать вывод.
Лабораторная работа №10(Глинка Н.Л.,2000, 9.1-9.3, Коровин Н.В., 2000, §9.1 ) Цель работы: опытным путем изучить окислительно-восстановительные реакции и установить:Теоретические сведения.Наиболее электроотрицательные элементы в соединении имеют отрицательные степени окисления, а атомы элементов с меньшей электроотрицательностью -… Степень окисления - формальное понятие; в ряде случаев степень окисления не… Например: N2H4 (гидразин)Опыт 1. Окислительные свойства перманганата калия в зависимости от реакции среды.рН среды ион среды Изменение окраски схема превращения перманганат иона. <7 Н+ … Реакции с участием перманганата калия в качестве окислителяОпыт №2. Химические свойства металлов. Взаимодействие металлов с концентрированными и разбавленными кислотами.Лабораторная работа № 11 ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ. ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ (Глинка Н.Л., 2000, 9.3.1, Коровин Н.В., 2000, §9.2-9.5, 9.8) Цель занятия: изучить условия возникновения и работы гальванических пар в различных средах. Теоретические сведенияЭлектрохимические процессы относятся к окислительно-восстановительным. В окислительно-восстановительных реакциях электроны непосредственно переходят… При погружении металлической пластинки в раствор собственной соли образуется… Преобразование химической энергии в электрическую осуществляется в устройствах, называемых гальваническими…D Gг.э = – n FE
Переход химической энергии системы в электрическую будет осуществляться самопроизвольно, если изменение свободной энергии системы, при переходе ее из начального состояния, в конечное меньше нуля.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ Выполнение работы: Один из стаканчиков 1 (см.рис.9) заполнить доверху 1М раствором сульфата цинка, другой – 1М раствором сульфата меди. Оба стаканчика поставить в углубления подставки 2. Соединить стаканчики электролитическим мостиком, заполненным насыщенным раствором хлорида калия в смеси с агар-агаром. Опустить в раствор сульфата цинка узкую цинковую пластинку, а в раствор сульфата меди – медную. Соединить электрическим проводом опущенные пластинки с гальванометром. Наблюдать отклонение стрелки гальванометра, указывающее на возникновение электрического тока вследствие разных значений электродных потенциалов цинка и меди. Запись данных опыта. Изобразить двойной электрический слой на границе раздела металл-раствор его соли на цинковом и медном электродах. Чем они отличаются качественно? Написать уравнения реакций, протекающих на электродах, и суммарное уравнение химической реакции, лежащее в основе работы гальванического элемента. В каком направлении переносятся электроны во внешней цепи? Вычислить стандартную ЭДС элемента. Какие ионы и в каком направлении перемещаются в растворе? Простейший гальванический элемент состоит из 2-х металлов, различной степени активности, погруженных в растворы собственных солей (электроды I рода). Например: цинковая и медная пластины соединены проводником и погружены соответственно в растворы сульфата цинка и сульфата меди. Найдем значения стандартных потенциалов для меди и цинка
Цинковый электрод, имеющий меньшее значение электродного потенциала, будет выполнять роль анода, медь – катода. Схема гальванического элемента ē
(-) А: Zn | ZnSO4 | | CuSO4 | Cu :К (+)
Процессы, протекающие на электродах:
(-) A: Zn0 – 2 e- (+) K: Cu2+ +2 e- Zn0 + Cu2+ Zn+CuSO4
Лабораторная работа №12(Глинка Н.Л., 2000, 38.5, Коровин Н.В., 2000, глава 10.) Цель работы: опытным путем изучить процессы химической и электрохимической коррозии металлов; факторы, влияющие на…Опыт 1.Качественная реакция на ион Fe2+.3FeSO4 + 2K3[Fe(CN)6] = Fe3[Fe(CN)6]2 + 3K2SO4 3Fe2+ + 2[Fe(CN)6]3- = Fe3[Fe(CN)6]2¯Турнбулева синь Опыт 2. Коррозия оцинкованного (Fe-Zn) и луженого (Fe-Sn) железа в кислой среде.Поместите в пробирки пластинки оцинкованного и луженого железа. Через несколько минут наблюдайте появление синего окрашивания в одной из пробирок (в… Запись данных опыта. Составьте схемы гальванических элементов, образующихся… Составьте уравнение анодного процесса и процесса катодной деполяризации. Какой вид электрохимической коррозии…Опыт 3. Зависимость скорости коррозии железа от рН среды.Запись данных опыта.Отмечайте последовательность появления синего окрашивания турнбулевой сини в пробирках. Результаты наблюдений запишите в…Зависимость скорости коррозии железа от рН среды.Опыт 4. Коррозия железа под каплей жидкости. Выполнение работы. В пробирке приготовить смесь из 10 капель 3% раствора NaCl,… Запись данных опыта. Почему анодная зона образуется в центре капли, а по краям ее возникает катодная зона? Можно ли…ЭЛЕКТРОЛИЗ ВОДНЫХ РАСТВОРОВ ЭЛЕКТРОЛИТОВ (Глинка Н.Л.-2000, 9.5-9.7, Коровин Н.В.-2000, 9.6-9.7) Цель работы: познакомиться с процессами, протекающими на растворимых и нерастворимых электродах при электролизе водных растворов электролитов.
Теоретические сведения.Для осуществления электролиза к отрицательному полюсу внешнего источника постоянного тока присоединяют катод, а к положительному полюсу — анод,… На поверхности электрода, подключенного к отрицательному полюсу источника… В результате электролиза на электродах (катоде и аноде) выделяются соответствующие продукты восстановления и…При электролизе кислородсодержащих кислот и их солей (SO42–, NO3–, PO43– и т. п.) с максимальной степенью окисления неметалла на аноде окисляются не анионы, а молекулы воды с выделением кислорода, так как потенциал окисления воды значительно меньше, чем для таких анионов 2H2O – 4e– = O2 + 4H+, φ0=1,228 В
На растворимом аноде в процессе электролиза происходит окисление материала, из которого изготовлен анод (см. опыт №1 - б) Законы электролиза.I закон Фарадея. Количества веществ, выделяющихся на электродах при электролизе, прямо пропорциональны количеству электричества, прошедшего через… где Q – количество электричества, пропущенного через раствор или расплав электролита Q = I∙t,ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ Опыт №1. Электролиз раствора CuSO4 с угольным и медным анодами.Не отключая электролизер от выпрямителя, поменять местами электроды в коленах электролизера, вследствие чего электрод, покрывшийся вначале медью,… а) с угольным анодомОпыт №2. Электролиз раствора KI с графитовым анодом.KI ® K+ + I- ½ ½ (-) Катод (графит) Анод (+) K+ φО=-2,92B I- φО=0,54B H2O …Опыт №3. Электролиз раствора Na2SO4 с графитовым анодом.Na2SO4 → 2Na+ + SO42- ½ ½ (-) Катод (графит) Анод (+) Na+ φО=-2,71B SO42- φО=2,01B …СВИНЦОВЫЙ АККУМУЛЯТОРЦель работы:изучение работы свинцового аккумулятора. …Теоретические сведения.Готовый к употреблению свинцовый аккумулятор состоит из решетчатых свинцовых пластин, одни из которых заполнены диоксидом свинца, а другие —… В аккумуляторе под действием внешнего источника тока накапливается…Pb, PbO2, PbSO4 │H2SO4 │ PbSO4, PbO2, PbЗарядка:PbO2 + SO4 2- + 4H+ + 2ē = PbSO4 + 2Н2O (-) Анод: Pb -2ē = Pb2+ Pb + SO4 2- -2ē = PbSO4 _________________________________________________________ Рb + РbO2 + 2Н2SO4= 2PbSO4 + 2Н2OТаким образом, металлический свинец служит в свинцовом аккумуляторе анодом и заряжен отрицательно, а РbО2 служит катодом и заряжен положительно. … Во внутренней цепи (в растворе H2SO4) при работе аккумулятора происходит… Суммарная реакция в аккумуляторе:ИССЛЕДОВАНИЕ СОСТАВА И НЕКОТОРЫХ СВОЙСТВ ПОРТЛАНДЦЕМЕНТА. (Глинка Н.Л.,2000, глава 34, Коровин Н.В., 2000, стр. 403) Цель работы:опытным путем изучить химический состав вяжущих веществ, изучить реакции процесса твердения портландцемента (силикатного цемента). Опыт 1. Изучение качественного состава водной вытяжки портландцемента.К нескольким каплям водной вытяжки цемента (отфильтрованный раствор) добавьте каплю фенолфталеина и отметьте изменение окраски индикатора. Какие… К другой порции вытяжки (1-2 мл) прилейте раствор карбоната натрия. Что…Ca(OH)2↓ + Na2CO3 → CaCO3↓ + 2NaOH Опыт 2. Проведение частичного растворения и разрушения портландцемента с помощью кислоты.Какой реакцией можно объяснить образование геля? Напишите соответствующие уравнения реакций. (NH4)2C2O4 + Ca2+ → CaC2O4 + 2NH4+Опыт 3. Качественная реакция на ион Al3+.Al3+ + 3 NH4OH → Al(OH)3↓ + 3NH4+– Конец работы – Используемые теги: курсу, quot, Химия, quot, студентов, нехимических, специальностей0.115 Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: По курсу "Химия" для студентов нехимических специальностей Что будем делать с полученным материалом:Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
Хотите получать на электронную почту самые свежие новости?
Подпишитесь на Нашу рассылку
Наша политика приватности обеспечивает 100% безопасность и анонимность Ваших E-Mail
Реклама |

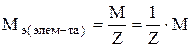 ,
,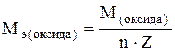



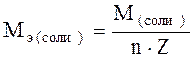


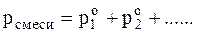
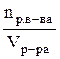 ,
, 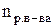 =
= ,
, 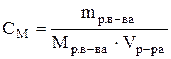 .
.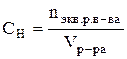 ,
, 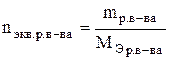 ,
,  .
.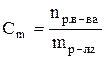 ,
, 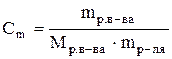
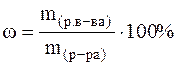 .
.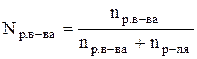 ,
, 

 ,
,  .
.
 H2SO4 98% 30 г H2SO4
H2SO4 98% 30 г H2SO4
 30%
30% 68 г H2O
68 г H2O 98 г 30% р-ра
98 г 30% р-ра г (98 % р-ра H2SO4).
г (98 % р-ра H2SO4).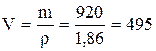 мл (98 % р-ра H2SO4)
мл (98 % р-ра H2SO4) г
г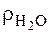 =1 г/мл, следовательно, V
=1 г/мл, следовательно, V =2080 мл = 2,08 л.
=2080 мл = 2,08 л.
 моль
моль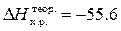 кДж*)
кДж*)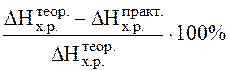
 – T D Sох.р,
– T D Sох.р, .
.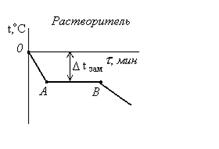 Рис.5
Рис.5
 Рис.6
Рис.6
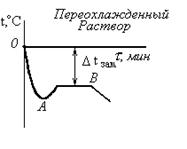 Рис.7
Рис.7
 +2NaCl
+2NaCl
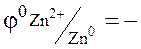 0, 76В
0, 76В 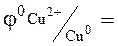 0,34 B.
0,34 B.



 Zn2+
Zn2+




Новости и инфо для студентов