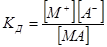Равновесия в растворах электролитов
При растворении электролитв в происходит распад их на катионы и анионы (электролитическая диссоциация). СЛ.6(0) Если растворяемое вещество — сильный электролит и полностью распадается на ионы, например MA → M+(р)+ A−(р), СЛ.6(1) равновесная концентрация исходного вещества в растворе [MA] = 0, а концентрации катионов и анионов равны концентрации исходного вещества: [M+] = [A−] = c0. СЛ.6(2) В этом случае степень диссоциации (отношение количества вещества, распавшегося на ионы, к исходному количеству вещества) равна: СЛ.6(3):
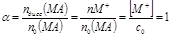
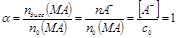
СЛ.7(0) Если в растворе наряду с катионами и анионами присутствуют молекулы растворенного вещества MA → MA(р)+M+(р)+A−(р), СЛ.7(1) равновесные концентрации [MA] > 0, [M+] = [A−] < c0, электролит называют слабым. В этом случае:
СЛ.7(2) 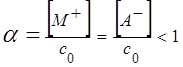
СЛ.7(3) В растворах слабых электролитов существует равновесие MxAy(р)Û xMa+(р)+yAb−(р), СЛ.7(4) которое, согласно закону действующих масс, может быть описано соответствующей константой равновесия, имеющей специальное название — константа диссоциации
СЛ.7(5) 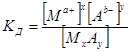
Рассмотрим связь между константой диссоциации и степенью диссоцации слабого электролита. СЛ.8(0) Для простоты рассмотрим электролит, диссоциирующий на один катион и один анион:
MA Û M+ + A−. В этом случае:
СЛ.8(1)