ПРИНЦИП ЛЕ ШАТЕЛЬЕ. СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ
Положение химического равновесия зависит от следующих параметров реакции: температуры, давления и концентрации веществ. Влияние, которое оказывают эти факторы на химическую реакцию, подчиняются закономерности, которая была в общем виде высказана в 1884 г. французским физико-химиком Ле-Шателье, подтверждена в том же году голландским физико-химиком Вант-Гоффом. Современная формулировка принципа Ле-Шателье такова: если система находится в со стоянии равновесия, то любое воздействие, которое выражается в изменении одного из факторов, определяющих равновесие, вызывает в ней изменение, стремящееся ослабить это воздействие.
Таким образом, химическая система способна нивелировать влияние изменения внешних условий.
В принципе Ле-Шателье речь идет о смещении состояния динамического химического равновесия, этот принцип называется также принципом подвижного равновесия, или принципом смещения равновесия.
Рассмотрим использование это го принципа для различных случаев:
Влияние температуры. При изменении температуры сдвиг химического равновесия определяется знаком теплового эффекта химической реакции. В случае эндотермической реакции, т. е. реакции, идущей с поглощением тепла, повышение температуры способствует ее протеканию, поскольку в ходе реакции температура понижается. В результате равновесие смещается вправо, концентрации продуктов увеличиваются, их выход растет. Если температура понижается, то наблюдается обратная картина: равновесие смещается влево (в сторону обратной реакции, протекающей с выделением тепла), концентрация и выход продуктов уменьшаются.
Для экзотермической реакции, наоборот, повышение температуры приводит к смещению равновесия влево, а понижение температуры — к смещению равновесия вправо.
Изменения концентраций продуктов и реагентов связаны с тем, что при изменении температуры изменяется константа равновесия реакции (описывается уравнением Вант Гоффа). Увеличение константы равновесия приводит к повышению выхода продуктов, уменьшение — к понижению.
Так, например, повышение температуры в случае эндотермического процесса разложения карбоната кальция CaCO3(т) Û CaO(т)+ CO2(г) − Q вызывает смещение равновесия вправо, а в случае экзотермической реакции распада монооксида азота на простые вещества
2NO Û N2+ O2 +Q повышение температуры смещает равновесие влево, т. е. способствует образованию NO.
Влияние давления. Давление оказывает заметное влияние на состояние химического равновесия только в тех случаях, когда хотя бы один из участников химической реакции — газообразное вещество. Повышение давления в таких системах сопровождается уменьшением объема и увеличением концентрации всех газообразных участников реакции.
Сдвиг равновесия после прекращения воздействия, т. е. при достижении системой нового объема V, в соответствии с принципом Ле Шателье должен привести к уменьшению давления, что обеспечивается протеканием реакций в том направлении, в котором общее количество газов в с и с т е м е (n) уменьшается (так как pV = nRT, то при неизменных V и T уменьшение давления (p) требует уменьшения n). Практически это означает, что направление смещения равновесия определяется величиной Δν — разностью сумм стехиометрических коэффициентов для газообразных веществ в правой и левой частях стехиометрического уравнения. Если в ходе прямой реакции количество газообразных веществ увеличивается (Δν>0), то повышение давления приводит к смещению равновесия влево (количество газов уменьшается при обратной реакции). Если в ходе реакции количество газообразных веществ уменьшается (Δν<0), при повышении давления равновесие смещается вправо. Если количества газообразных реагентов и продуктов равны между собой, изменение давления не приводит к смещению химического равновесия. Например, при синтезе аммиака: N2 + 3H2 Û 2NH3 из четырех моль газообразных веществ образуются два (Δν = −2 < 0). Значит, увеличению выхода аммиака будет способствовать повышение давления, вызывающее сдвиг данного равновесия вправо.
Следует отметить, что изменение давления не оказывает влияния на константу равновесия. Данное воздействие приводит к изменению парциальных давлений (и концентраций) газов, участвующих в реакции.
Влияние концентрации.Согласно принципу Ле-Шателье, повышение концентрации одно го из участников реакции (что осуществляется введением дополнительного количества этого вещества в систему при ее неизменном объеме) должно привести к его расходованию. Таким образом, если в систему при V = const добавлять реагент, равновесие сместится вправо, а если продукт реакции — влево. Удаление то го или иного вещества из системы (уменьшение его концентрации) дает обратный эффект. Сказанное выше легко проиллюстрировать с помощью закона действующих масс. Так, в простейшем случае:
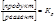
и рост концентрации реагента приводит к росту концентрации продукта, и наоборот. Так, для увеличения выхода продукта в реакции: 2SO2+ O2 Û 2SO3 можно увеличить концентрацию кислорода (используя, например, чистый кислород вместо воздуха), а при проведении реакции этерификации: CH3OH + CH3COOH Û CH3COOCH3+ H2O выход продукта увеличивается в присутствии концентрированной серной кислоты, которая проявляет водоотнимающие свойства (уменьшается концентрация воды).
Все сказанное выше относится и к жидким, и к газообразным растворам (смесям газов).