рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Вид работы: Контрольные Работы
- /
- Виды напряжений в органических молекулах
Реферат Курсовая Конспект
Виды напряжений в органических молекулах
Виды напряжений в органических молекулах - Контрольная Работа, раздел Химия, Предмет органической химии. История развития органической химии. Основные положения и значение теории химического строения 1. Торсионное Напряжение (Напряжение Питцера) Вызвано...
1. Торсионное напряжение (напряжение Питцера) вызвано электростатическим взаимодействием противостоящих связей.
2. Напряжение Ван-дер-Ваальса, возникающее при расположении заместителей на расстоянии, приблизительно равном сумме их ван-дер-ваальсовых радиусов.
3. Угловое напряжение (напряжение Байера),вызванное отклонением валентного угла в цикле от нормального угла для данного валентного состояния.
Геометрия реальной молекулы соответствует той конформации, в которой энергия внутримолекулярных взаимодействий имеет минимальное значение.
Конформациямимолекулы определенной конфигурации называются состояния молекулы с различным расположением ее атомов в пространстве, возникающие в результате вращения вокруг связей. Конформер это молекула в конформации, в которую ее атомы самопроизвольно возвращаются после небольших сдвигов. Наиболее стабильными являются конформации, в которых атомы испытывают наименьшее межмолекулярное отталкивание. Их называют заторможенными. И наоборот, конформации в которых атомы располагаются близко, являются нестабильными и называются заслоненными. Возможность перехода одной конформации в другую определяется барьером вращения.
Свободному вращению вокруг одинарной связи препятствуют при сближении групп наряду с взаимным ван-дер-ваальсовым отталкиванием изменения:
· торсионного (питцеровского) напряжения (квантово-химическое взаимодействие соседних σ-связей, например, в конформации «ванна» циклогексана);
· углового, или байеровского, напряжения (в циклоалканах);
· дипольных взаимодействий или водородных связей;
· энергии сольватации (в растворителе при смене растворителя);
· напряжения связей вследствие их растяжения или сжатия (при изменении температуры);
· взаимодействия несвязных атомов.
Структура конформеров часто оказывает решающее влияние на физические и химические свойства соединений, поэтому так интенсивны исследования в этой области в настоящее время.
Для изображения процесса вращения по связи С–С удобно пользоваться двумерными изображениями соединений, которые предложил М. Ньюмен (1955 г.):
Торсионный угол (j) – двугранный угол, образованный плоскостями, в которых лежат связи соседних атомов четырехатомного фрагмента.
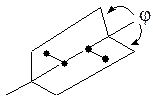
За минимальный отсчет торсионного угла принято считать 60о. В результате полного оборота возникает бесконечное множество конформаций, шесть из них с торсионными углами, кратными 60о, соответствуют максимумам и минимумам на энергетической кривой.
Энергетический барьер вращения – разность потенциальных энергий двух крайних конформаций (1 и 5); для этана – 12 кДж/моль, для н-бутана – 25,5 кДж/моль.
Конформеры – относительно устойчивые конформации (4, 5, 6).
Названия конформаций:
· синперипланарная (syn – вместе, plan – плоскость) – (1);
· антиперипланарная (anti – напротив), трансоидная – (5);
· синклинальная (гр. klino – выгибаю) – (4, 6);
· антиклинальная – (2, 3).
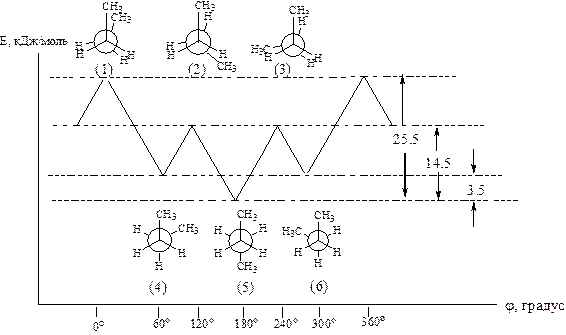
Рисунок 12 – Потенциальная энергия конформации н-бутана

анти- гош-
Рисунок 13 – Стабилизация конформации за счет внутримолекулярной водородной связи

конформационные энантиомеры н-бутана
Рисунок 14 – Конформационная энантиомерия
С удлинением углеродных цепей возникают различные конформации цепи. Например:
· зигзагообразная:

· клешневидная:

d-гидроксивалериановая d-валеролактон
кислота (5-гидроксипента- (пентанолид-1,5)
новая кислота)
· нерегулярная:
Особенно сложна картина цепной конформации у полимерных молекул с длинной цепей. В жидких и твердых алканах с большим значением Сn наиболее устойчива регулярная зигзагообразная конформация, обеспечивающая максимальное межмолекулярное взаимодействие соседних СН2 -групп.
Конформации циклов возникают за счет изменения колебательных состояний атомов и атомных группировок, что создает возможность образования многих неустойчивых форм.
Низшие циклоалканы (циклопропан и циклобутан) сравнительно жесткие и малоустойчивые образования, способные размыкаться при взаимодействии со многими реагентами.
Причина необычного поведения малых циклов заключается в особенностях электронного строения. Полагают, что в молекуле циклопропана из-за углового напряжения, т. е. значительного отклонения валентного угла от нормального для sp3-гибридизации (109°28'), при образовании связей С–С не достигается максимальное перекрывание атомных орбиталей. Из-за сближенности (угол равностороннего треугольника – 60°) электронные облака испытывают сильное взаимное отталкивание. В результате эти облака перекрываются не по прямой, соединяющей центры ядер, а под углом, вне треугольника молекулы:
Таким образом, С–С-связи в циклопропане отличаются от обычных σ-связей при sp3-гибридизации: они изогнуты и не обладают цилиндрической симметрией. Такие связи называют «банановыми», или τ-связями. Они занимают промежуточное положение между σ- и π-связями. Поскольку в такой связи не достигается максимальное перекрывание атомных орбиталей, она достаточно слаба, что и проявляется в легкости раскрытия цикла и образовании продуктов присоединения.
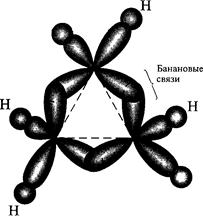
Рисунок 15 – Схема перекрывания АО в молекуле циклопропана
Поэтому циклопропан и напоминает по свойствам олефины, хотя он значительно пассивнее последних.
Средние и макроциклы достаточно устойчивы и близки по свойствам к алканам.
В 1885 г. А. Байер предположил, что неустойчивость малых циклов объясняется так называемым угловым напряжением – отклонением угла между связями от нормального валентного угла при sp3-гибридизации.
В 1890 – 1919 гг. Г. Сакс и Е. Мор предположили и обосновали возможность неплоского расположения атомов в циклах. Циклические углеводороды изгибаются в пространстве таким образом, чтобы отклонение валентного угла от нормального было минимальным. Напряжение, выводящее молекулу из плоскости, называется торсионным напряжение Питцера, напряжение заслоненных связей (от англ. слова «torsion» - кручение).
Циклы изгибаются в пространстве, образуя конформации, в которых угол между связями соответствует или приближается к нормальному валентному углу насыщенного атома углерода. Конформационная изомерия циклоалканов обеспечивает устойчивость средних и больших циклов.
Устойчивость той или иной конформации определяется угловым напряжением и торсионным эффектом, возникающим, когда заместители у соседних атомов углерода отклоняются от заторможенной конформации.
Например:
· молекула циклобутана может перейти из плоского состояния в неустойчивое неплоское:
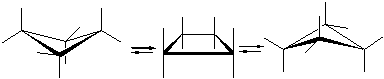
· молекула циклопентана может находится в конформациях “конверт” и “полукресло”:
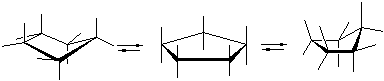
· молекула циклогексана может находится в конформациях “кресло”(от англ. chаir-кресло), “ванна” (лодка, от англ. boat-лодка) и “твист”:
Разделить конформации циклогексана невозможно, так как при обычных температурах они быстро превращаются друг в друга. Однако конформация кресла, как более стабильная, составляет при обычных условиях более 99 % равновесной смеси.

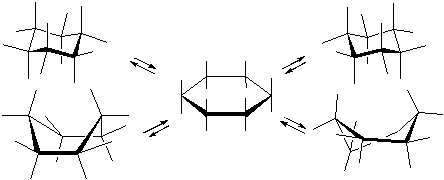
Конформация кресло имеет ось симметрии третьего порядка. Атомы углерода в ней располагаются в двух параллельных плоскостях. Шесть связей С–Н параллельны оси симметрии и называются аксиальными (а). Остальные располагаются почти перпендикулярно оси и занимают так называемое экваториальное положение (е).

Рисунок 16 – Расположение оси симметрии в молекуле циклогексана
1,3-Диаксиальное взаимодействие – ван-дер-ваальсово взаимодей-ствие между объемными заместителями, расположенными на аксиальных связях в положении – 1,3.

Рисунок 17 – 1,3-Диаксиальное взаимодействие заместителей

Рисунок 18 – Стабилизация аксиального конформера за счет водородной связи
Таблица 3 – Конформационный анализ дизамещенных циклогексанов.
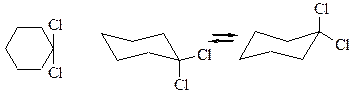
| а, е = е, а | |

| е, а = а, е | |

| е, е > a, a | |

| e, e > a, a | |

| e, a = a, e | |

| e, a = a, e | |

| e, e > a, a |
Вывод: Термодинамическая устойчивость
цис – 1, 2 < транс – 1, 2
цис – 1, 3 > транс – 1, 3
цис – 1, 4 < транс – 1, 4
Конформации играют большую роль в химии средних (С7 – С10) и больших (С12 и больше) циклов. Здесь положения атомов водорода, которые замещаются при синтезе функциональных производных, еще более неэквивалентны, чем у циклогексана. Так, молекула циклодекана в конформации “алмаз” имеет четыре атома водорода, расположенные внутри цикла, которые сильно сближены друг с другом:
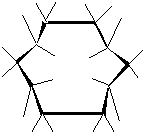
Это приводит к необычным свойствам циклоалканов. Введение в циклоалканы гетероатомов (O, N, S, P и т. д.) приводит к гетероциклам. Гетероатом изменяет свойства конформаций и, нередко, конформации устойчивые для циклоалканов становятся неустойчивыми, и наоборот.
Геометрическая изомерия (π-диастереомерия) – стереомерия, обусловленная различным расположением заместителей в пространстве относительно плоскости π-связи.
π-связь
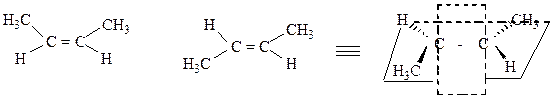
цис-бутен-2 (Z) транс-бутен-2 (E)
Условия, необходимые для π-диастереомерии:
· наличие π-связи;
· у атомов углерода, соединенных двойной связью наличие разных заместителей.
Е-изомеры, в которых старшие заместители у углеродных атомов двойной связи находятся по разные стороны (нем. entgegen– напротив) относительно плоскости связи. Z-изомеры, в которых старшие заместители располагаются по одну сторону относительно плоскости двойной связи (нем. zusammen – вместе).
Превращение изомеров друг в друга в обычных условиях не возможно без разрыва двойной связи и цис–, транс– изомеры существуют как индивидуальные соединения.
Оптическая изомерия обусловлена возможностью пространственной асимметрии молекул. Я. Вант-Гофф и независимо от него Ж. Ле Бель в 1874 г. выдвинули гипотезу о пространственной конфигурации насыщенного углеродного атома – тетраэдрическом расположении заместителей. Асимметрические молекулы называют хиральным (от греч. χειρ (хиро) – рука). Молекула хиральна, если отсутствуют плоскость и центр симметрии. Ось симметрии может быть.
Хиральные молекулы обладают способностью поворачивать плоскость поляризованного света на определенный угол. Это явление называют оптической активностью, а соответствующие молекулы оптически активными.
Оптические изомеры, вращающие плоскость поляризации вправо, называют правовращающими и обозначают знаком “+”, влево – левовращающимии обозначают знаком “–“.
Плоскость симметрии – это воображаемая плоскость, которая рассекает объект на две зеркально противоположные половины.
Центр симметрии – это точка, относительно которой на прямой, проходящей через нее, можно встретить тождественные точки на одном и том же расстоянии.

| Молекула ахиральна | Молекула хиральна | Плоскость симметрии – молекула ахиральна |

Рисунок 19 – Схемы зеркальных изомеров производных дифенила
Хиральный центр – sp3-гибридизованный атом (C, N, Si, P) с четырьмя разными лигандами.
Асимметрический атом углерода – хиральный атом, т. е. sp3-гибридизованный с четырьмя разными партнерами. В структурной формуле обозначается С*.
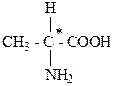
2-аминопропановая кислота
Два стереоизомера, относящиеся друг к другу как предмет и его зеркальное отражение, называют антиподами или энантиомерами. Например молочная кислота:

В поисках универсального способа для выражения абсолютной конфигурации была разработана система Кана – Ингольда – Прелога (1956 г.) или система абсолютной R, S – конфигурации (от лат. rectus – правый, sinister – левый). Система основана на старшинстве заместителей при асимметричном атоме углерода:
· атом или атом заместителя, непосредственно связанный с хиральным центром, с большим атомным номером является старшим относительно атома с меньшим атомным номером;
· большее массовое число имеет преимущество перед меньшим, в том числе и изотопов;
· неподеленные пары электронов имеют самый низкий порядок, в том числе и по сравнению с водородом;
· если с хиральным центром связаны два идентичных атома, то старшим считается тот, который связан с атомом с большим атомным номером (процедура может повторяться);

· если атом двоесвязан, то по старшинству он приравнивается к атому, связанному с двумя эквивалентными группами, т. е. атомный номер удваивается.
Однако для углеводов и аминокислот используют D (+), L (–) номенклатуру. В качестве стандарта при использовании D, L номенклатуры Э. Фишер предложил правовращающую, т. е. (+) – глюкозу.
– Конец работы –
Эта тема принадлежит разделу:
Предмет органической химии. История развития органической химии. Основные положения и значение теории химического строения
Программа по органической химии включает ознакомление не только с основными классами и типами органических веществ но также с основными положениями... Программа составлена с учетом современных достижений теоретической... В течение семестра рекомендуется проводить контрольных работ позволяющих проверить усвоение текущего материала...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Виды напряжений в органических молекулах
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов