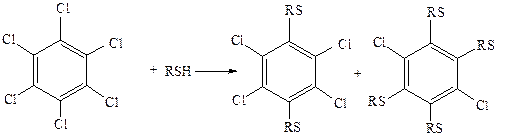Химические свойства
1. Кислотные свойства. Тиолы более сильные кислоты, чем соответствующие спирты (рК этантиола –10,5, а этанола –18). Легкая поляризуемость атома серы, вследствие большего атомного радиуса и меньшей электроотрицательностью по сравнению с атомом кислорода, способствует делокализации отрицательного заряда, образующегося алкилсульфид-иона RS– и, следовательно, повышает его стабильность.
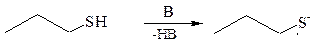
1.1 Образование солей. Тиолы образуют растворимые в воде соли тиоляты – с щелочными металлами и нерастворимые – с тяжелыми металлами (ртутью, свинцом, цинком). Это свойство тиолов нашло свое отражение в названии меркаптаны (от лат. mercurius captans – связывающий ртуть).
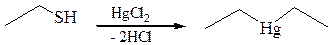
Способность тиолов связывать ионы тяжелых металлов позволяет использовать их как противоядия при отравлениях соединениями мышьяка, ртути, хрома, висмута.
1.2.Взаимодействие со щелочами:
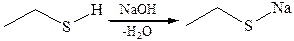
1.3 Взаимодействие с оксидами:
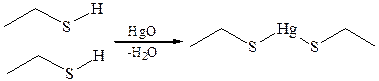
2. Нуклеофильные свойства. Многие реакции тиолов протекают по ионному механизму с участием тиолат-анионов, обладающих сильными нуклеофильными свойствами. Тиолат-анионы генерируются из тиолов в растворах NaOH, триэтаноламина, пиридина и др., а также образуются при взаимодействии эфиров тиолов (например, CH3COSR) с сильными основаниями в неводных средах либо при гидролизе тиомочевины.
2.1 Реакции с галогенидами металлов. Тиолат-анионы легко замещают атомы галогена (обычно Сl) в галогенидах В, Si, Sn, Ge, P, Мо и других, например:
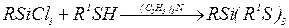
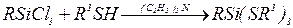
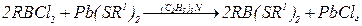
2.2 Реакции тиолат-анионов с алкилхлоридами протекают в жидком NH3, с гексахлор- и гексафторбензолом – в среде этиленгликоля или пиридина (гексабромбензол с тиолат-анионами не реагирует), например: