Реакции элементорганических соединений
4.1 Металлорганические соединения, в основном магний- и литийорганические, при взаимодействии с альдегидами, кетонами, производными карбоновых кислот позволяют легко получать спирты с удлинением углеродной цепи:
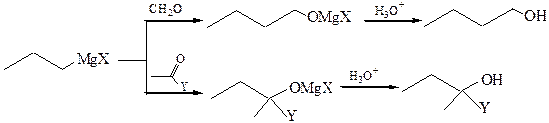
где Х=Hal, Y= H, R, Hal, OR, NH2, NR2, OCOR; R= алкил, арил.
4.2 Окисление металлорганических соединений:

В промышленности применяют окисление алюминий- и борорганических соединений (К. Циглер):
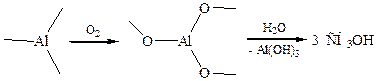
4.3 Гидроборирование – окисление алкенов:
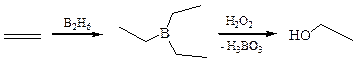
5. Ферментативные реакции. Наиболее древний способ получения этанола, при этом используют растительное сырье (крахмал, картофель, патока, древесина):
(С6Н10О5)n  С2Н5ОН + СО2
С2Н5ОН + СО2
6. Гидролиз галогеналканов. Реакция протекает при нагревании галогеналканов с водой (обратимо) или щелочью:
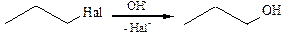
Физические свойства и строение. Низшие спирты – жидкости с характерным запахом, выше С10 – твердые вещества почти без запаха. Спирты могут образовывать водородные связи:
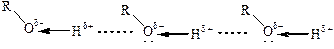
Энергия водородной связи составляет 20–40 кДж/моль, что на порядок ниже энергии ковалентных связей (ЕН–О = 456 кДж/моль). Таким образом, молекулы спирта ассоциированы за счет водородных связей, и при нагревании требуется дополнительная энергия для их разрушения и переведения молекул в газообразное состояние. Ориентационное взаимодействие делает молекулярные кристаллы спиртов и фенолов более прочными, что приводит к повышению температур плавления и кипения по сравнению с углеводородами и галогенуглеводородами с близкой молекулярной массой. Чем меньше углеводородный радикал, больше гидроксильных групп, тем значительней такое повышение. Все эти закономерности прослеживаются в таблице 9.
С удлинением углеводородной цепи относительное влияние водородных связей уменьшается, поэтому высшие одноатомные спирты по своим физическим свойствам близки к соответствующим углеводородам.
Возможность образования водородных связей между молекулами спиртов и воды способствует растворению спиртов в воде, которая увеличивается при уменьшении углеводородного радикала (гидрофобной части) и увеличении числа гидроксильных групп. Высшие спирты по растворимости в воде подобны обычным углеводородам.
Таблица 9 – Физические свойства спиртов
| Формула | Название | Мол. масса | Температура, °С | Растворимость в воде при 20°С г/на 100 г | |
| плавления | кипения | ||||
| CH3OH | метанол, метиловый спирт | –98 | неограниченно | ||
| CH3CH2OH | этанол, этиловый спирт | –117,3 | 78,5 | неограниченно | |
| CH3(CH2)2OH | пропанол-1, пропиловый спирт | –127 | неограниченно | ||
| CH3CH(OH)CH3 | пропанол-2, изопропи-ловый спирт | –88,5 | неограниченно | ||
| CH3(CH2)3OH | бутанол-1, бутиловый спирт | –89,6 | 117,9 | ||
| CH3(CH2)7OH | октанол-1, октиловый спирт | –16,7 | 0,059 | ||
| CH2(OH)CH2(OH) | этилен-гликоль | –13,2 | 197,2 | неограниченно | |
| CH2(OH)CH(OH)CH2(OH) | глицерин | 17,9 | 290 (разл.) | неограниченно | |
| C6H5OH | фенол | 181,2 | 8,2 | ||
| C6H4(OH)2 | гидрохинон | ПО | 170,5 | 286,2 | 5,9 |
Таблица 10 – Физические параметры связей С–O и О–Н
| Связь | Длина, нм | Средняя энергия связи, кДж/моль | Полярность, μ, D | Поляризумость, RD, см3 |
| С–O | 0,143 | 0,8 | 1,54 | |
| О–Н | 0,096 | 1,51 | 1,64 |
Полярность С–О и О–Н связей в спиртах и фенолах подтверждается наличием у них дипольного момента. НЭП атома кислорода вносят существенный вклад в реакционную способность данного класса соединений, однако вследствие высокой электроотрицательности атома кислорода связи С–О и О–Н обладают невысокой поляризуемостью.
Уменьшение длины связи С–О фенолов (0,136 нм) по сравнению со спиртами (0,143 нм), связанное с разностью ковалентных радиусов C(sp2) и С(sp3), приводит к ее упрочнению в фенолах. Частично это может быть связано с сопряжением ОН группы с бензольным кольцом. Сопряжение играет определяющую роль в уменьшении энергии связи О–Н в фенолах по сравнению со спиртами, так как в реакции:
RO–H  RO• + Н•
RO• + Н•
образующийся фенокси-радикал стабилизирован сопряжением, что делает его образование энергетически более предпочтительным по сравнению с алкоксирадикалом.
Пространственная ориентация связей кислорода и природа его НЭП зависят от характера углеводородного заместителя. Атом кислорода, имеющий электронную конфигурацию внешнего слоя 2s22p4 может, как атомы азота или углерода, образовывать связи в различных состояниях. Sp3 гибридизация осуществляется для предельных спиртов, в которых угол связи С–O–H близок к тетраэдрическому (105–108о). У фенолов наблюдается sp2 гибридизация, валентный угол равен 120о, а НЭП занимают свободную р и sp2 орбитали. При нахождении атома кислорода в основном состоянии валентный угол будет составлять 90о, а НЭП будут находиться на s и p орбиталях, т. е. будут энергетически неравноценными.
Химические свойства алканолов. Реакции гидроксилсодержащих соединений могут протекать как с участием гидроксильной группы, так и с участием углеводородного радикала.
Гидроксильная группа как функциональная группа обуславливает главные химические свойства этого класса органических соединений. В реакциях могут разрываться либо связи С–О, либо связи О–Н. Существенный вклад в реакционную способность вносит также НЭП атома кислорода. Среди реакций спиртов можно выделить несколько важнейших типов превращений (рисунок 1).
· Полярность связи С–О предопределяет ее склонность к гетеро-литическому разрыву, в результате чего возможны реакции замещения гидроксигруппы. Поскольку на С-атоме субстрата имеется дефицит электронов, то его атаковать может только нуклеофил. Поэтому для гидроксилпроизводных характерны реакции нуклеофильного замещения ОН-группы (SN реакции).
· В процессе превращения гетеролизу может подвергаться связь СО–Н. В этом случае гидроксилпроизводное, отдавая протон, проявляет кислотные свойства.
· Благодаря наличию на атоме кислорода НЭП гидроксилпроизводное может присоединять протон, т. е., согласно протолитической теории, проявлять свойства основания.
· Благодаря этой же НЭП гидроксилсодержащее соединение может участвовать в реакции в роли нуклеофильного реагента.
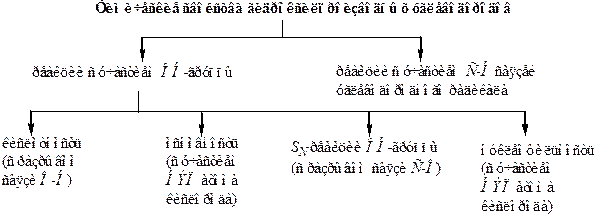
Рисунок 1 – Схема реакционной способности алканолов
1. Реакции с сохранением атома кислорода. Кислотно-основные свойства спиртов. Водные растворы спиртов нейтральны и, подобно воде, амфотерны.
Кислотные свойства связаны с высокой полярностью связи О–Н, что приводит к ее ионизации. Легкость разрыва связи О–Н, т. е. степень депротонирования гидроксилпроизводного, определяется полярностью и энергией диссоциации этой связи: чем выше полярность связи О–Н и устойчивее образующийся анион, т. е. ниже энергия диссоциации, тем легче разрывается связь О–Н и выше кислотность. Следовательно, ЭА заместители, связанные с ОН-группой, повышают кислотность соединения, а ЭД заместители ее понижают.
Понижение кислотных свойств спиртов происходит под влиянием алкильного радикала, вызывающего положительный индукционный эффект, который противодействует поляризации связи О–Н (+I алкильного радикала нагнетает избыточную электронную плотность на атом кислорода и полярность связи О–Н уменьшается). Сила положительного индукционного эффекта возрастает с увеличением размера и степени разветвленности алкиального радикала, поэтому кислотные свойства убывают при переходе от первичных к третичным спиртам.
1.1 Образование алкоголятов, их свойства: