Образование сложных эфиров
2.3.1 С минеральными кислотами:
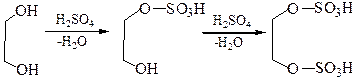
2.3.2 С карбоновыми кислотами и их производными:
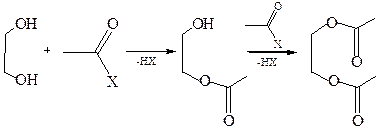
3. Реакция дегидратации многоатомных спиртов (расщепление связи С–О). В присутствии водоотнимающих агентов и сильных кислот многоатомные спирты подвергаются дегидратации. Однако в зависимости от типа дегидратирующего агента, условий реакции, строения многоатомного спирта возможно протекание различных реакций, в результате чего может образоваться сложная смесь продуктов.
3.1Внутримолекулярная дегидратация 1,2-, 1,3-, 1,4-диолов, возможно образование ненасыщенных спиртов, а затем сопряженных 1,3-диенов:
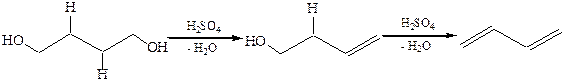
3.2Внутримолекулярная циклизация 1,4- и 1,5-диолов с образованием циклических простых эфиров:
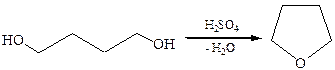
3.3Внутримолекулярная дегидратация. Продуктом реакции в этом случае уксусный альдегид, так как виниловый спирт, образующийся на промежуточной стадии, неустойчив и претерпевает изомеризацию в уксусный альдегид:
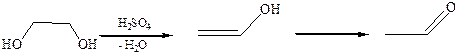
3.3.1Дегидратация дитретичных 1,2-диолов (пинаконов). В зависимости от условий образуются различные продукты.
3.3.1.1Нагревание с Al2O3 в качестве основного продукта образуется сопряженный диен:
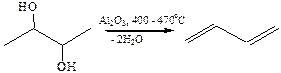
3.3.1.2Кислотно-каталитическая дегидратация. Реакция сопровождается перегруппировкой углеродного скелета (пинаколиновая перегруппировка). Механизм реакции включает две стадии: 1) отщепление воды; 2) перегруппировка карбкатиона, за счет 1,2-алкильного сдвига:
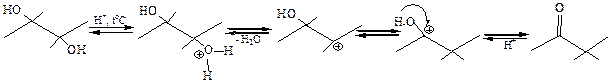
3.4Межмолекулярная дегидратация с образованием простых эфиров:
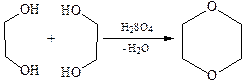
3.5Дегидратация глицерина, при нагревании с гидросульфатом калия, отщепляя две молекулы воды, глицерин превращается в непредельный альдегид – акролеин:
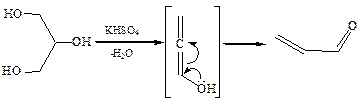
Акролеин обладает резким, неприятным запахом, раздражает слизистые оболочки носа и глаз.
4. Окисление многоатомных спиртов.Продукты окисления многоатомных спиртов многообразны, поскольку являются результатом последовательного окисления каждой гидроксильной группы до карбонильной и карбоксильной. В случае этиленгликоля, в зависимости от условий окисления и характера окислителя, могут получиться следующие продукты:
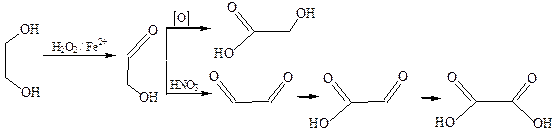
Все эти продукты являются метаболитами обменных процессов в живых организмах.
4.1 Реакция Малапрада (1928 г.). С накоплением в молекуле спирта гидроксильных групп легкость окисления возрастает. Α-гликоли могут подвергаться окислению под действием слабых окислителей – йодной кислоты или тетраацетата свинца. В результате окисления происходит разрыв С–С связи и образуются карбонильные и карбоксильные соединения:
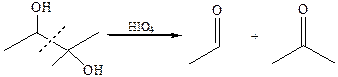
3.3 ФЕНОЛЫ И АРОМАТИЧЕСКИЕ СПИРТЫ
Фенолы относятся к оксипроизводным ароматического ряда, у которых гидроксильная группа связана непосредственно с ароматическим кольцом. Общая формула фенолов Аr–ОН.
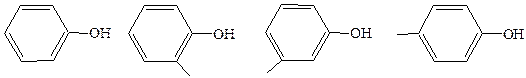
фенол о-крезол м-крезол n-крезол
Фенолы занимают особое положение среди оксипроизводных углеводородов благодаря выраженному взаимному влиянию гидроксильной группы и ароматического ядра.
Встречаются также соединения с гидроксильной группой в боковой цепи – ароматические спирты (например, бензиловый спирт). Свойства гидроксильной группы в ароматических спиртах не отличаются от свойств спиртов алифатического ряда:
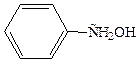
бензиловый спирт
Фенолы могут быть одноатомными и многоатомными:
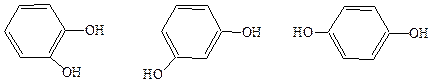
пирокатехин гидрохинон резорцин
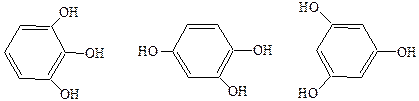
пторогаллол гидроксигидрохинон флюоресцин
3.3.1 ОДНОАТОМНЫЕ ФЕНОЛЫ