Способы получения
1. Природным источником фенола и его гомологов служит каменный уголь, при сухой перегонке которого образуется каменноугольная смола. Разгонкой последней получают фракцию «карболового масла» (Ткип 160–230 °С), содержащую фенол и крезолы.
2. Гидролиз галогенбензолов. Хлорбензол гидролизуется с образованием фенола действием концентрированной щелочи в гораздо более жестких условиях (350–400 °С, 30 МПа), чем аналогичное превращение хлорэтана в этанол в алифатическом ряду:
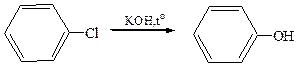
3. Щелочное плавление ароматических сульфокислот:
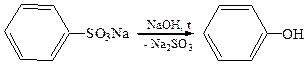
2. Кумольный метод (Р.Ю. Удрис, П.Г.Сергеев, 1949 г.):
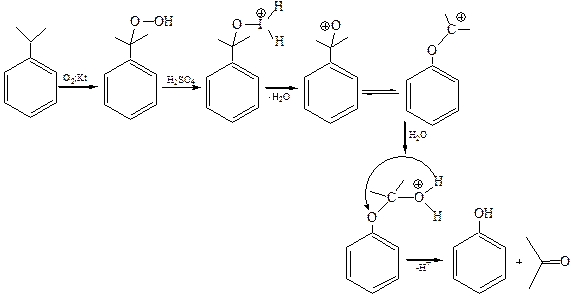
5. Прямое гидроксилирование, катализаторами служат соли Fe2+, Cu2+, Ti3+:
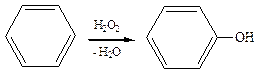
6. Гидролиз арендиазониевых солей:
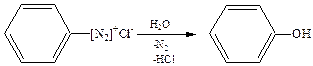
7. Окислительное декарбоксилирование карбоновых кислот:
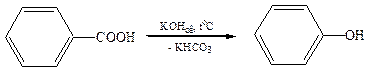
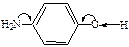
Физические свойства, строение. Простейшие фенолы – сравнительно низкоплавкие твердые вещества, реже – высококипящие жидкости. Растворимость фенола в воде несколько выше, чем у его гомологов, что обусловлено образованием водородных связей с молекулами воды:
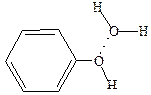
Растворимость гомологов фенола ниже, а двух- и трехатомных фенолов выше. Собственно фенол образует бесцветные прозрачные кристаллы, которые обычно окрашены за счет примесей продуктов их окисления кислородом воздуха.
Таблица 12 – Номенклатура и физические свойства фенолов
| Формула | Номенклатура | Тпл., оС | Ткип., оС | Растворимость, г/100 г Н2О |
| C6H5OH | фенол | 9,3 | ||
| o-CH3C6H5OH | 2-метилфенол | 2,5 | ||
| м-CH3C6H5OH | 3-метилфенол | 2,6 | ||
| п-CH3C6H5OH | 4-метилфенол | 35,5 | 2,3 | |
| o-ClC6H5OH | 2-хлорфенол | 2,8 | ||
| м-ClC6H5OH | 3-хлорфенол | 2,6 | ||
| п-ClC6H5OH | 4-хлорфенол | 2,7 | ||
| o-NO2C6H5OH | 2-нитрофенол | 0,2 | ||
| м-NO2C6H5OH | 3-нитрофенол | – | 1,4 | |
| п-NO2C6H5OH | 4-нитрофенол | – | 1,7 | |
| (NO2)3C6H5OH | 2,4,6-тринитрофенол | – | 1,4 |
Фенол ядовит, вызывает ожоги при попадании на кожу. Его действие связано со способностью денатурировать белки, вследствие чего водные растворы фенола (карболовая кислота) использовали в качестве антисептического средства для дезинфекции и обеззараживания при хирургических операциях. В настоящее время фенол вытеснен другими антисептиками.
Молекула фенола является плоской:
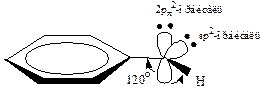
Все особенности свойств фенолов объясняются его электронным строением. Помимо эффекта π,π-сопряжения в бензольном кольце важнейшее значение для поведения молекулы имеет взаимное влияние заместителя и ядра. Со стороны гидроксильного кислорода, как более электроотрицательного атома, на бензольное кольцо действует –I эффект, который, однако, невелик. Решающее значение для поляризации молекулы имеет взаимодействие между НЭП атома кислорода и π-электронным облаком бензольного кольца, +М (р,π) эффект возникает в результате перекрывания общего π-электронного облака бензольного ядра и негибридизованной р-орбитали атома кислорода, несущей НЭП:
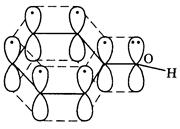
В составе образующегося общего π-электронного облака электронная плотность, выравниваясь, перераспределяется от атома кислорода в сторону кольца. Эффект +М (р,π) в фенолах значительно сильнее –I эффекта. Вследствие сопряжения связь С–О у фенолов становится короче и прочнее в сравнении со спиртами, так как она носит частично двойной характер. В то же время связь О–Н, напротив, ослабляется и становится более полярной.
Таблица 13 – О–Н кислотность некоторых спиртов и фенолов
| Структурная формула и электронное смещение | Тип заместителя связанного с –ОН группой | Ка | Структурная формула и электронное смещение | Тип заместителя в бензольном кольце | Ка |
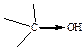
| ЭД (+I) | 
| 
| ЭД (+М) | 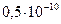
|
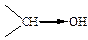
| ЭД (+I) | 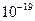
| 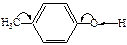
| ЭД (+М) | 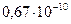
|
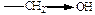
| ЭД (+I) | 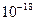
| 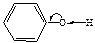
| 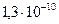
| |
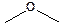
| 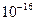
| 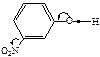
| ЭА (–I) | 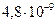
| |
| Продолжение таблицы 13 | |||||
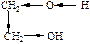
| ЭА (–I) | 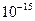
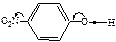
| 
| ЭА (–I) | 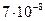
|
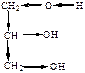
| ЭА (–I) | 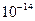
| 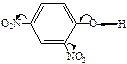
| ЭА (–I; –М) | 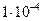
|
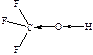
| ЭА (–I) | 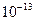
| 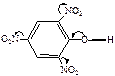
| ЭА (–I; –М) | 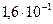
|
Таким образом, взаимное влияние гидроксила и ядра приводит к увеличению кислотных свойств ОН-группы, в то же время затрудняются реакции замещения ОН-группы, сопряженные с разрывом связи С–О:
Очевидно, легкость разрыва связи О–Н, т. е. степень депротонирования гидроксилпроизводного, будет определяться полярностью и энергией диссоциации (ЕD) этой связи. Естественно, чем выше полярность связи О–Н и устойчивее образующийся при диссоциации этой связи анион, т. е. чем ниже ЕD, тем легче разрывается связь О–Н, тем выше кислотность. Следовательно, ЭА заместители, связанные с ОН-группой, повышают О–Н кислотность соединения, а ЭД ее понижают.
В порядке возрастающей кислотности ряды гидроксильных соединений можно расположить следующим образом:
· спирты < НОН < фенолы < Н2СО3;
· третичные < вторичные < первичные спирты < НОН;
· одноатомные спирты < диолы < триолы;
Поведение бензольного ядра под влиянием гидроксильной группы также меняется. Реакционная способность его в реакциях электрофильного замещения резко повышается по сравнению с незамещенным бензолом. Причиной подобного активирования бензольного ядра является эффект сопряжения, благодаря которому ядро обогащается электронной плотностью. При этом характер перемещения электронов таков, что избыток отрицательного заряда концентрируется в орто- и пара-положениях к гидроксилу:
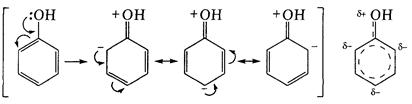
Химические свойства. Фенолы обнаруживают высокую реакционную способность, проявляя два ряда свойств: по фенольному гидроксилу и ароматическому ядру.