рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Атомная эпоха
Реферат Курсовая Конспект
Атомная эпоха
Атомная эпоха - раздел Химия, Натурфилософский (греческий) период. Алхимический период. Техническая химия и ятрохимия Открытие Электрона Э. Вихертом И Дж. Дж. Томсоном (1897 Год) ...
Открытие электрона Э. Вихертом и Дж. Дж. Томсоном (1897 год) и радиоактивности А. Беккерелем (1896 год) стали доказательством делимости атома, возможность которой стала обсуждаться после выдвижения в 1888 г. У. Круксом гипотезы о протиле (Уильям Крукс предположил, что все элементы, в том числе и водород, возможно, образованы путём уплотнения некоторой первичной материи – протила. Очень малый атомный вес протила, по мнению Крукса, делает возможным возникновение дробных атомных весов). Уже в начале XX века появились первые модели строения атома: «кексовая» (У. Томсон, 1902 год и Дж. Дж. Томсон, 1904), планетарная (Ж. Б. Перрен, 1901 год и Х. Нагаока, 1903 год), «динамидическая» (Ф. Ленард, 1904). В 1911 Э. Резерфорд, основываясь на опытах по рассеиванию α-частиц, предложил ядерную модель, ставшую основой для создания классической модели строения атома (Н. Бор, 1913 год и А. Зоммерфельд, 1916). Основываясь на ней, Н. Бор в 1921 заложил основы формальной теории периодической системы, объяснившей периодичность свойств элементов периодическим повторением строения внешнего электронного уровня атома. После того, как В. Паули сформулировал принцип запрета (1925), а Ф. Хунд предложил эмпирические правила заполнения электронных оболочек (1925—1927), была в целом установлена электронная структура всех известных к тому времени элементов.
После открытия делимости атома и установления природы электрона как его составной части возникли реальные предпосылки для разработки теорий химической связи. Первой стала концепция электровалентности Р. Абегга (1904) основанная на идее о сродстве атомов к электрону (Согласно этой концепции, валентностью обладают ионы и её величина равна заряду иона. Каждый элемент характеризуется двумя максимальными валентностями — положительной и отрицательной; одна из них, более характерная для данного элемента, — «нормальная», другая — «контрвалентность»). Модель Бора — Зоммерфельда, представления о валентных электронах (И. Штарк, 1915) и идея об особой стабильности двух- и восьмиэлектронных оболочек атомов инертных газов легли в основу классических теорий химической связи. В. Коссель (1916) разработал теорию гетерополярной (ионной) связи, а Дж. Н. Льюис (1916) и И. Ленгмюр (1919) — теорию гомеополярной (ковалентной) связи.
В конце 20-х — начале 30-х годов XX века сформировались принципиально новые — квантово-механические — представления о строении атома и природе химической связи.
Исходя из идеи французского физика Л. де Бройля о наличии у материальных частиц волновых свойств, австрийский физик Э. Шрёдингер в 1926 году вывел основное уравнение т. н. волновой механики, содержащее волновую функцию и позволяющее определить возможные состояния квантовой системы и их изменение во времени. Несколько ранее немецкий физик В. Гейзенберг разработал свой вариант квантовой теории атома в виде матричной механики.
Квантово-механический подход к строению атома привёл к созданию новых теорий, объясняющих образование связи между атомами. Уже в 1927 году В. Г. Гейтлер и Ф. Лондон начали разрабатывать квантовомеханическую теорию химической связи (В основе теории валентных связей лежит гипотеза о том, что при образовании молекулы из атомов, последние в значительной мере сохраняют свою электронную конфигурацию, а связывание атомов достигается в результате обмена электронов между ними и спаривания спинов двух электронов, находящихся на атомных орбиталях исходных атомов) и выполнили приближённый расчет молекулы водорода. Распространение метода Гейтлера-Лондона на многоатомные молекулы привело к созданию метода валентных связей, который создают в 1928—1931 гг. Л. Полинг и Дж. К. Слэтер. Основная идея этого метода заключается в предположении, что атомные орбитали сохраняют при образовании молекулы известную индивидуальность. В 1928 году Полинг предложил теорию резонанса и идею гибридизации атомных орбиталей, в 1932 году — новое количественное понятие электроотрицательности.
В 1929 году Ф. Хунд, Р. С. Малликен и Дж. Э. Леннард-Джонс заложили фундамент метода молекулярных орбиталей, основанного на представлении о полной потере индивидуальности атомов, соединившихся в молекулу. Хунд создал также современную классификацию химических связей; в 1931 году он пришёл к выводу о существовании двух основных типов химических связей — простой (σ-связи) и π-связи. Э. Хюккель распространил метод молекулярных орбиталей на органические соединения, сформулировав в 1931 году правило ароматической стабильности, устанавливающее принадлежность вещества к ароматическому ряду.
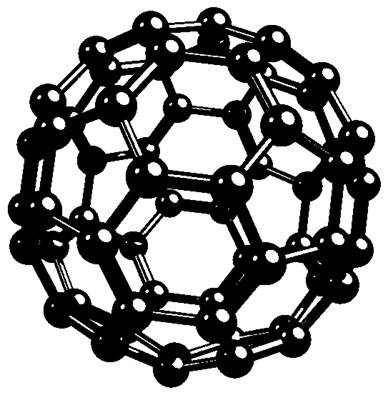
Фуллерен С60 — аллотропная форма углерода,
открытая в 1985 г.
Благодаря квантовой механике к 30-м годам XX века в основном был выяснен способ образования связи между атомами; кроме того, в рамках квантово-механического подхода получило корректную физическую интерпретацию менделеевское учение о периодичности. Создание надёжного теоретического фундамента привело к значительному росту возможностей прогнозирования свойств вещества. Особенностью химии в XX веке стало широкое использования физико-математического аппарата и разнообразных расчётных методов.
Подлинным переворотом в химии стало появление в XX веке большого числа новых аналитических методов, прежде всего физических и физико-химических (рентгеноструктурный анализ, электронная и колебательная спектроскопия, магнетохимия и масс-спектрометрия, спектроскопия ЭПР и ЯМР, хроматография и т. п.). Эти методы предоставили новые возможности для изучения состава, структуры и реакционной способности вещества.
Отличительной чертой современной химии стало её тесное взаимодействие с другими естественными науками, в результате которого на стыке наук появились биохимия, геохимия и др. разделы. Одновременно с этим процессом интеграции интенсивно протекал и процесс дифференциации самой химии. Хотя границы между разделами химии достаточно условны, коллоидная и координационная химия, кристаллохимия и электрохимия, химия высокомолекулярных соединений и некоторые другие разделы приобрели черты самостоятельных наук.
Закономерным следствием совершенствования химической теории в XX веке стали новые успехи практической химии — каталитический синтез аммиака, получение синтетических антибиотиков, полимерных материалов и т. п. Успехи химиков в деле получения вещества с желаемыми свойствами в числе прочих достижений прикладной науки к концу XX столетия привели к коренным преобразованиям в жизни человечества.
– Конец работы –
Эта тема принадлежит разделу:
Натурфилософский (греческий) период. Алхимический период. Техническая химия и ятрохимия
СОДЕРЖАНИЕ Введение Натурфилософский... Атомная эпоха...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Атомная эпоха
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов