Вычисления в титриметрическом методе анализа основаны на законе эквивалентов, согласно которому вещества реагируют в эквивалентных количествах











Задание №1. Вычисления в титриметрии
Вычисления в титриметрическом методе анализа основаны на законе эквивалентов, согласно которому вещества реагируют в эквивалентных количествах.
Если определяемое вещество А реагирует с раствором титранта В по уравнению
νАА + νВВ → продукты реакции (1)
или
А + νВ /νА В → продукты реакции (2)
где νА > νВ, означает, что одна частица А будет эквивалентна νВ /νА частицы вещества В.
Эквивалентными массами этих веществ будут νАМ(А) и νВМ(В), где М(А) и М(В) – молярные массы веществ А и В, а νА и νВ – стехиометрические коэффициенты; νВ /νА= 1/z(B)
МЭ (А)= 1/zМ(А) (3)
МЭ(В)= 1/zМ(В) (4)
где МЭ(А), МЭ(В) – молярные массы эквивалентов веществ А и В; z – эквивалентное число, 1/z – фактор эквивалентности, показывающий, какая доля реальной частицы вещества эквивалентна одному иона водорода в данной кислотно-основной реакции или одному электрону в данной реакции окисления –восстановления.
Фактор эквивалентности является безразмерной величиной, равной или меньшей единицы.
Для любой химической реакции
νЭ(А) = νЭ(В) (5)
Сэ(А)·V(А) = Сэ(В)·V(В) (6)
где νЭ(А), νЭ(В) – количество молярных эквивалентов веществ А и В соответственно, СЭ, СВ - молярные концентрации эквивалентов растворов веществ А и В соответственно; V(A), V(B) – объемы растворов веществ А и В.
Молярной концентрацией эквивалента называют отношение количества вещества эквивалента в растворе к объему раствора(размерность моль/л, допускают написание мольэкв/л)
Например, С(1/2H2SO4) = 0,1 мольэкв/л или 0,1 н
Соотношение (6) выражает важное следствие из закона эквивалентов, применяющееся для расчетов в титриметрии.
Если А – определяемое вещество,а В – титрант, то
Сэ(А)) = Сэ(В)·V(В)/V(A) (7)
Наряду с молярной концентрацией эквивалента в титриметрическом анализе используют и другие способы выражения концентрации раствора: молярную. концентрацию эквивалента с поправочным коэффициентом, титр раствора, титр по определяемому веществу (условный титр)
Поправочный коэффициент равен отношению истинной концентрации (Сист) титранта к табличной его концентрации (Стабл), для которой заранее можно рассчитать, какой массе определяемого вещества соответствует 1 мл титранта. Если истинная молярная концентрация эквивалента NaOH равна 0,1048, то поправочный коэффициент
К = Сист/ Стабл, = 0,1048/0,1 = 1,048 (8)
При расчете результатов титрования учитывают поправку, умножая на нее (Стабл).
Титр титранта (масса вещества в 1 мл раствора):
 , г/см3 (8)
, г/см3 (8)
Масса определяемого вещества в заданном объеме раствора m(A)
m(A) = T(A)· V, г (9)
где V- заданный объем раствора, мл (см3)
Титр по определяемому веществу
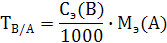
Варианты заданий РГР
Примечание. Для четных номеров перечня заданий принять А=NaOH, B=H2SO4; для нечетных – A=KOH, B=HCl
| №п/п | Исследуемый раствор (А) | Титрант(В) | ||||||
| СЭ | V | T | m | CЭ | V | T | m | |
| 0,05 0,10 0,15 0,10 0,12 0,20 0,10 0,15 0,20 0,07 0,10 0,05 0,10 0,15 0,10 0,12 0,14 0,10 | 5,0 10,0 5,0 5,0 10,0 5,0 10,0 5,0 5,0 5,0 10,0 5,0 10,0 5,0 10,0 5,0 5,6 10,0 5,0 | 0,4000 | 0,05 0,20 0,18 0,17 0,16 0,15 0,14 0,11 0,08 0,05 0,20 0,18 0,17 0,16 0,15 0,20 0,11 | 5,0 5,0 5,6 8,0 5,4 5,5 5,2 5,0 5,0 8,0 5,4 | 7,35·10-2 1,23·10-2 3,65·10-3 7,35·10-2 | 5,8800 14,7000 0,9100 5,8800 14,700 |
Задание №2.Определение кислотности воды
Вода хозяйственно-питьевого назначения должна иметь рН 6,5-8,5.Это условие является стандартом качества воды. Такое требование связано с удовлетворением физиологических потребностей человека. Для большинства природных источников величина рН не выходит за эти пределы.Первая стадия закисления соответствует снижению рН до 5,5, вторая стадия – от 5,5 до 5,0, третья стадия – до 4,5 – 4,0. Величина рН характеризует такой показатель воды как кислотность. В природных водах кислотность воды обусловлена прежде всего содержанием растворенного в ней углекислого газа, гуминовых и слабых органических кислот, не приводящих к понижению рН ниже 4,5.
Значение рН – мера кислотности среды, активной кислотности. Это концентрация ионов водорода (рН5, следовательно, [Н+]= 10-5 моль/л)
Для количественной характеристики кислотности используют также показатель«общая кислотность» (КО), выражающаяся через концентрацию молярного эквивалента кислоты и определяющаяся количественно титриметрически с титрантом щелочью в присутствии индикатора фенолфталеина
Таким образом, под общей кислотностью воды понимают содержание в ней веществ, вступающих в реакцию с сильными щелочами, т.е. с гидроксид-ионами.
Активная кислотность (КА) составляет только часть общей кислотности и тем большую, чем выше степень диссоциации кислот, присутствующих в воде.
Свободная кислотность (КС) применяется для характеристики растворов с рН≤ 4,5 и выражается количеством молярных эквивалентов щелочи, необходимых для нейтрализации 1 л раствора до рН4,5. Свободная кислотность, обусловленная наличием в анализируемых пробах воды свободных кислот, определяется титрованием в присутствии индикатора метилового оранжевого до рН4,5 (рТ4,0).
рТ (показатель титрования индикатора) – величина рН, при которой заканчивается титрование с данным индикатором. Показатель титрования находится обычно в середине интервала перехода индикатора. У метилового оранжевого рТ 4,0, у фенолфталеина 9,0. У правильно подобранного индикатора рТ практически совпадает с рН в точке эквивалентности.
На практике часто оперируют такими понятиями как первичная и вторичная кислотность. Первичная кислотность обусловлена наличием в воде свободных кислот. Вторичная кислотность – кислотность, обусловленная гидролизом солей слабых оснований и сильных кислот.
Количественное определение кислотности основано на методе кислотно-основного титрования. В зависимости от поставленной задачи выбирают соответствующий индикатор (фенолфталеин или метиловый оранжевый) и титруют анализируемую пробу воды стандартным (0,1н) раствором щелочи.
При титровании в присутствии фенолфталеина происходит нейтрализация щелочью слабых кислот, точка эквивалентности соответствует щелочной среде (рН>7, 8,38). При титровании в присутствии метилового оранжевого точка эквивалентности фиксируется в кислой среде (рН<7, 4,0).
Расчет результатов анализа Хфф или Хмо проводят по формуле, соответствующей принципу эквивалентности:
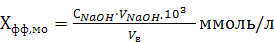 (13)
(13)
где СNaOH – молярная концентрация эквивалента щелочи, моль/л;
VNaOH – объем раствора щелочи, пошедший на титрование, мл;
Vв – объем пробы воды, взятый для анализа, мл
103 – пересчетный коэффициент моль/л на ммоль/л
Индивидуальные задания РГР
Используя полученные исходные данные, рассчитать общую и свободную кислотность образцов воды.
| Варианты | Показатели титрования | ||||
| Vв, мл | VNaOH, мл | CNaOH, моль/л | Хфф ммоль(э)/л | Хмо ммоль(э)/л | |
| - - - | - | 0,05 0,1 0,1 0,05 0,05 0,05 0,1 0,1 0,1 - 0,1 0,05 0,1 0,05 0,1 0,1 | - - - - | - - - - - - - - - |
Задание №3
| Варианты | Титрант (HCl) | Анализируемая вода | ||
| СHCl моль/л | VHCl, мл | Vв, мл | Що, ммоль/л | |
| 0,05 0,10 0,15 0,12 0,05 0,10 0,11 0,07 0,12 0,15 0,10 0,02 | 20,0 7,5 60,0 10,0 30,0 24,0 17,5 19,2 4,8 4,0 8,0 5,0 |