Завдання для самоконтролю до теми
"Хімічна термодинаміка"
1. Що вивчає термохімія?
2. Дайте визначення тепловому ефекту реакції. Назвіть типи хімічних реакцій за тепловим ефектом?
3. Сформулюйте закон Гесса та його наслідки.
4. Як скласти та записати термохімічне рівняння?
5. Як визначити тепловий ефект реакції за стандартними ентальпіями утворення?
6. Від чого залежить тепловий ефект реакції?
7. Які параметри стандартного стану?
8. Що характеризує ентропія?
9. За значенням якої термодинамічної функції можна визначити напрямок перебігу процесу?
10.Порівняйте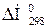 реакцій відновлення ферум (ІІІ) оксиду різними відновниками при 298 К: а) Fe2O3(к) + 3CO(г) = 2Fe(к) + 3CO2(г);
реакцій відновлення ферум (ІІІ) оксиду різними відновниками при 298 К: а) Fe2O3(к) + 3CO(г) = 2Fe(к) + 3CO2(г);
б) Fe2O3(к) + 3C(графіт) = 2Fe(к) + 3CO(г);
в) Fe2O3(к) + 3Н2(г) = 2Fe(к) + 3Н2O(г).
Визначте, якою із речовин можна найбільш ефективно і повно відновити залізо із оксиду Fe2O3 за умови 1100 К.
11. Обчисліть значення 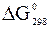 реакцій та визначте, які з них можливі:
реакцій та визначте, які з них можливі:
а) Cu(к) + ZnO(к) = CuO(к) + Zn(к); б) FeO(к) + CO(г) = Fe(к) + CO2(г);
в) 3Fe3O4(к)+ 8Al(к)= 9Fe(к) + 4Al2O3(к); г) FeO(к) + 1/2C(графіт) = Fe(к) + 1/2CO2(г).
12. Обчисліть значення 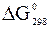 та визначте, які з оксидів можуть бути відновлені алюмінієм при 298 К: СаО, FeO, CuО, РbO, Fe2O3, Cr2O3.
та визначте, які з оксидів можуть бути відновлені алюмінієм при 298 К: СаО, FeO, CuО, РbO, Fe2O3, Cr2O3.
13. Визначте знак зміни ентропії 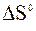 наступних процесів за рівняннями:
наступних процесів за рівняннями:
а) 2NO(г) + O2(г) = 2NO2(г); б) 2H2S(г) + 3O2(г) = 2H2O(p) + 2SO2(г);
в) CO2(к) = CO2(г); г) 2N2(г) + O2(г) = 2N2O(г);
д) NH4NO3(к) =N2(г) + 2H2O(г) + ½O2(г).