Способи вираження концентрацій
1. 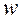 - Масова частка речовинидорівнює відношенню маси речовини до маси розчину .
- Масова частка речовинидорівнює відношенню маси речовини до маси розчину .
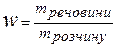
|
Процентна концентрація: 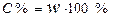
2. 
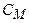 -Молярна концентрація(молярність)- це кількість моль розчиненої речовини в 1л розчину.
-Молярна концентрація(молярність)- це кількість моль розчиненої речовини в 1л розчину.
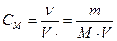 
|
3.  Моляльна концентрація, відображає число моль розчиненої речовини в 1кг розчинника
Моляльна концентрація, відображає число моль розчиненої речовини в 1кг розчинника
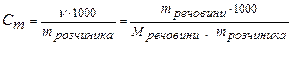 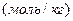
|
4. 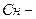 Нормальна концентрація(молярна концентрація еквівалентна),
Нормальна концентрація(молярна концентрація еквівалентна), 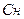 визначається числом молярних мас еквівалентів речовини в 1л розчину
визначається числом молярних мас еквівалентів речовини в 1л розчину
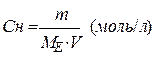
|
Наприклад: 1н. 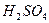 (однонормальний розчин ) -це означає, що в 1л розчину міститься 1 молярна маса еквівалента
(однонормальний розчин ) -це означає, що в 1л розчину міститься 1 молярна маса еквівалента 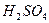 , тобто
, тобто 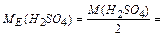 49г/моль
49г/моль
Характеристики слабких електролітів і рН:
1.Ступінь дисоціації слабкого електроліту -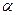
2.Константа дисоціації слабкого електроліту - 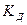
3. Закон розведення Оствальда (співвідношення між 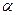 (ступенем дисоціації) і
(ступенем дисоціації) і 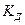 (константою дисоціації)):
(константою дисоціації)):
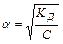 ,С-концентрація розчину
,С-концентрація розчину
4. Водневий показник рН= -lg[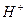 ] – характеризує кислотність середовища
] – характеризує кислотність середовища