Лабораторна робота №5
«Гальванічні елементи»
Мета роботи: вивчити хімізм процесів, які відбуваються під час роботи гальванічних елементів (ГЕ)
Щоб виконати роботу, Ви повинні знати:
1. Анод (А) – це електрод, на якому відбувається процес окиснення, тобто відщеплення електронів. З двох різних металів анодом завжди буде той, у якого значення відносного стандартного електродного потенціалу буде меншим (метал, який стоїть ближче до початку в ряду напруг металів).
2. Катод (К) – це електрод, на якому відбувається процес відновлення, тобто приєднання електронів.
3.У випадках, коли концентрація розчину солі металу не дорівнює 1 моль/л, необхідно використовувати рівняння Нернста для
розрахунку потенціала електроду.
 =
=
 CMen+, тут
CMen+, тут 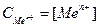 – концентрація розчину солі
– концентрація розчину солі
4.ЕРС елемента розраховується за формулою: ЕРС = ∆Е =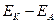
Наприклад:
Задача: Гальванічний елемент складається з металічного нікелю, зануреного в 0,1М розчин Нікель (ІІ) сульфату та металічного свинцю, зануреного в 0,01М розчин Плюмбум (ІІ) нітрату. Обчисліть ЕРС гальванічного елемента, напишіть рівняння напівреакцій електродних процесів.
Розв’язування:
1. За умовою задачі концентрація солі, в яку занурений нікелевий електрод,  ≠1моль/л, тому необхідно розрахувати потенціал Ni- електроду згідно з рівнянням Нернста:
≠1моль/л, тому необхідно розрахувати потенціал Ni- електроду згідно з рівнянням Нернста: 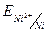 =
= 

 =
= = -0,25 + 0,03(-1) = - 0,28B
= -0,25 + 0,03(-1) = - 0,28B
- [Pb2+]≠1моль/л, тому необхідно розрахувати потенціал Pb-електрода за рівнянням Нернста.
 =
= 



 Анодом буде метал з меншим значенням Е.
Анодом буде метал з меншим значенням Е.
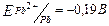 Потенціал Ni-електрода < потенціала Pb-електрода, тому Ni-електрод – анод.
Потенціал Ni-електрода < потенціала Pb-електрода, тому Ni-електрод – анод.
4. Запишіть схему ГЕ:
(А-)  (K+)
(K+)
5. Запишіть процеси, що відбуваються на електродах:
A:  (Анод – відщеплення електронів)
(Анод – відщеплення електронів)
K: 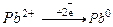 (Катод – приєднання електронів)
(Катод – приєднання електронів)
_________________
Ni0 + Pb2+ = Ni2+ + Pb0
Ni + Pb(NO3)2 = Ni(NO3)2 + Pb
6. ЕРС = ЕК – ЕА = -0,19 – (-0,28) = 0,09 В
ЕРС > 0 => Гальванічний елемент працює.
Література:
[1] с. 63-76; [2] с. 227-239; [3] с. 182-197; [4] с. 182-192; [5] с. 156-161