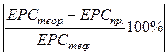Дайте відповіді на запитання
1. Що вивчає «електрохімія»?
2. Визначіть поняття «гальванічний елемент».
3. Визначить поняття «Анод».
4. Визначить поняття «Катод».
5. Що називається електрорушійною силою елемента (ЕРС)?
6. Запишіть вираз рівняння Нернста. У яких випадках його необхідно використовувати?
Завдання для самостійної роботи:
1.Складіть схеми двох гальванічних елементів, у одному з яких мідь буде катодом, а в іншому – анодом. Напишіть рівняння реакцій, які відбуваються під час роботи цих гальванічних елементів.
2.Як зміниться ЕРС гальванічного елемента : (А-) Pb | Pb2+ || Ag+ | Ag (К+), якщо до розчину солі Плюмбуму добавили сірководень (Н2S). Відповідь обґрунтуйте.
3.Чи буде працювати ГЕ, складений з нікелевого електрода, зануреного в розчин NiSO4 з концентрацією 0,01 моль/л і стандартного залізного електрода?
Самостійно вирішити задачі № 654, 658, 660, 661 [5. с. 162]
Виконайте роботу та заповніть лабораторний журнал:
Дотримуйтесь правил техніки безпеки! ! (стор5)
| № | Зміст роботи | Рівняння реакцій, спостереження, розрахунки | |||||||||||||||||||||||
| Дослід 1 Вимірювання ЕРС елемента Даніеля-Якобі Складіть гальванічний елемент: залийте у стаканчики з електродами одномолярні розчини CuSO4 і ZnSO4, у розчини опустіть електроди. Розчини з’єднайте електролітичним ключем (трубкою, заповненою електролітом). Запишіть показання вольтметра, тобто ЕРС практичну( ЕРСпр.). Ррозрахуйте ЕРС теоретичну і порівняйте з практичною. Алгоритм: 1.Виберіть анод. 2.Складіть схему ГЕ. 3.Напишіть рівняння процесів, що відбуваються на аноді та на катоді під час роботи ГЕ. 4.Розрахуйте теоретичне значення ЕРСтеор. 5.Запишіть ЕРСпр. 6.Знайдіть похибку досліду, ε% |
1.Вибір аноду: 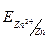 = -0.76B менш, ніж = -0.76B менш, ніж 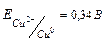 =>Zn – анод =>Zn – анод
2. Схема ГЕ: (A-) Zn ZnSО4 CuSО4 Cu (K+) 1М 1М 3.Процеси:
K: Cu+2
Zn + CuSO4 = Cu0 + ZnSO4
4.ЕРСтеор.=
5 ЕРСпр.=
6.ε %=
|
| Дослід 2 Вимірювання ЕРС елемента Вольта Складіть ГЕ Вольта: залийте в стаканчики з електродами H2SO4. Розчини з’єднайте електролітичним ключом. Запишіть ЕРСпр. (показання вольтметра). Алгоритм: 1.Визначте анод. 2.Складіть схему ГЕ. 3.Напишіть схеми процесів, що відбуваються на аноді та катоді. 4.Розрахуйте теоретичне значення ЕРСтеор. 5.Запишіть ЕРСпр. 6.Знайдіть похибку досліду, ε% | 1.Виберіть анод: 2.Схема ГЕ: 3.Процеси: А: К: 4.ЕРСтеор..= 5.ЕРСпр.= 6. ε %= (дивись дослід 1) | |||||||||||||||||||
Дослід 3
Вплив концентрації розчинів електролітів на ЕРС ГЕ
Cкладіть мідно-цинковий ГЕ (елемент Даніеля - Якобі).Заливайте в стаканчики CuSO4 і ZnSO4 різної концентрації за вказівкою викладача (табл.5, с.45).
Розчини з’єднуйте електролітичним ключем і заміряйте ЕРСпр. Розрахуйте рівноважні потенціали Е за формулою Нернста. Обчисліть ЕРСтеор., порівняйте її з практичною.
Складіть схему ГЕ, напишіть рівняння реакцій
Таблиця 5.ЗАВДАННЯ СТУДЕНТАМ
Алгоритм: 1.Розрахуйте значення потенціалу для Zn- електрода за рівнянням Нернста. 2 Розрахуйте значення потенціалу для Cu- електрода за рівнянням Нернста. 3. Виберіть анод 4. Складіть схему ГЕ 5. Напишіть схеми процесів, що відбуваються на аноді та на катоді під час роботи ГЕ. 6. Розрахуйте ЕРСтеор. 7. Запишіть ЕРСпр.. 8. Знайдіть похибку досліду (експерименту) ε % |
1. Разрахуйте потенціали електродів:
1.1 Zn- електрод:
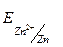 =
1.2 Cu- електрод: =
1.2 Cu- електрод:
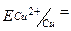 2. Який електрод буде анодом?
3. Схема ГЕ:
4. Процеси:
А:
К:
5.ЕРСтеор.=
6. ЕРС пр..=
7. ε%= (дивись дослід 1)
2. Який електрод буде анодом?
3. Схема ГЕ:
4. Процеси:
А:
К:
5.ЕРСтеор.=
6. ЕРС пр..=
7. ε%= (дивись дослід 1)
| |||||||||||||||||||
Висновки і місце для домашніх задач:
Оцінка____________ Число____________ Підпис викладача______________



 А: Zn0
А: Zn0 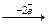 Zn2+ 2 1
Zn2+ 2 1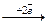 Cu0 2 1
Cu0 2 1
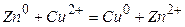
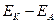 =0.34 – (-0.76)=1.1В
=0.34 – (-0.76)=1.1В