Щоб виконати роботу, Ви повинні знати!
1. Корозія металів- це мимовільно протікаючий окисно-відновний процес (DG<0) руйнування металу під впливом
навколишнього середовища, що відбувається з виділенням енергії ( DH<0) і розсіюванням речовини (DS >0).
2. Анод- це електрод, на якому відбувається процес окиснення, тобто віддача електронів.
3. Катод- це електрод, на якому відбувається процес відновлення, тобто приєднання електронів.
4. Хімічна корозія- це руйнування металів з окисненням в навколишньому середовищі без виникнення електричного
струму в системі.
5. Електрохімічна корозія -це просторово розділений окисно-відновний процес руйнування металу, який протікає в середовищі
електроліту і супроводжується виникненням усередині системи електричного струму, що зветься
корозійним струмом.
6.Протекторний захистполягає в тому, що до металевого виробу, який піддається електрохімічній корозії, підключають деталь – протектор, виготовлений з більш активного металу, ніж метал виробу. Протектор руйнується, а металевий вироб залишиться незмінним.
Приклад послідовного запису хімізму корозії :
Розглянемо атмосферну корозію сталевого виробу. Сталь - це сплав заліза з вуглецем, в якому вміст вуглецю менше 2%. У сталі присутній цементіт (Fe3C). Під час електрохімічної корозії у вологому повітрі (О2 + 2Н2О) залізо і цементіт утворюють мікрогальванопару, в якій роль анода виконує залізо, а цементіт - роль катода.
Схема процесу: (А-) Fе | О2 + 2Н2О | Fе3С (К+)
Анодний процес: Fе0 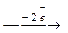 Fе2+ 2 поляризація
Fе2+ 2 поляризація
Катодний процес: О2 + 2Н2О 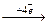 4ОH- 1 деполяризація
4ОH- 1 деполяризація
Сумарне рівняння корозійного процесу руйнування сталевого виробу, що знаходиться у вологому повітрі:
2Fе + 2Н2О + О2  2Fе(ОН)2
2Fе(ОН)2
Для заліза характерніший ступінь окиснення (3+), тому процес окиснення йде далі: 4Fе(ОН)2+ О2 + 2Н2О = 4Fе(ОН)3.
Під час нагрівання Fе(ОН)3 втрачає воду: Fе(ОН)3 →Н2О + FеО(ОН). Продукти корозії Fе(ОН)3 і FеО(ОН).
Література:
[1] с. 76-83; [2] с. 507-529; [3] с. 316-319; [4] с. 195-198;
Завдання для самостійної роботи:
1. Мідь не витісняє водень з розбавлених кислот. Чому? Проте, якщо до мідної пластинки, опущеної в кислоту, доторкнутися цинковою, то на міді починається бурхливе виділення водню. Дайте цьому пояснення, склавши електронні рівняння анодного і катодного процесів. Напишіть рівняння хімічної реакції.
2. Як відбувається атмосферна корозія лудженого заліза і лудженої міді при порушенні покриття? Складіть електронні рівняння анодного і катодного процесів.
3. Якщо пластинку з чистого цинку опустити в розбавлену кислоту, то виділення водню, що починається, незабаром майже припиняється. Проте при дотику до цинку мідною паличкою на останній починається бурхливе виділення водню. Дайте цьому пояснення, склавши електронні рівняння анодного і катодного процесів. Напишіть рівняння хімічної реакції.
4. У чому суть протекторного захисту металів від корозії? Приведіть приклад протекторного захисту заліза в електроліті, що містить розчинений кисень. Складіть електронні рівняння анодного і катодного процесів.
Дайте відповіді на запитання:
| № 1. | Запитання | Ваші відповіді |
| 1. | Дайте визначення поняттю «Корозія». | |
| 2. | Дайте визначення поняттю «Хімічна корозія» | |
| 3. | Дайте визначення поняттю «Електрохімічна корозія» | |
| 4. | Дайте визначення поняттю «Катод» | |
| 5. | Дайте визначення поняттю «Анод» | |
| 6. | Дайте визначення поняттю «Контактна корозія» | |
| 7. | Дайте визначення поняттю «Концентраційна корозія» | |
| 8. | Дайте визначення поняттю «Деполяризація» | |
| 9. | Що означає корозія з водневою деполяризацією? З кисневою? | |
| 10. | Який метал буде руйнуватися або підлягати корозії в зразку, що складається з нікелю Ni та міді Сu? | |
| 11. | Яке покриття краще анодне або катодне і чому? |
Самостійно вирішити задачу № 1125 [5. с. 219]
Виконайте роботу та заповніть лабораторний журнал:
Дотримуйтесь правил техніки безпеки! ! (стор5)
Особливо коли працюєте з розведеною H2SO4 , розчинами K3[Fe(CN)6] і K4[Fe(CN)6]
| № | Зміст роботи | Рівняння реакцій, спостереження, розрахунки | |
| Дослід №1 Типи корозійних руйнувань. Змочіть фільтрувальний папір розчином К3[Fе(СN)6] і покладіть його на зачищену поверхню залізної пластинки. Зверху покладіть 2-3 листи чистого паперу і невеликий вантаж. Через 20 хвилин зніміть фільтрувальний папір і роздивіться форми синіх плям. Зробіть висновок про тип корозійного руйнування: суцільна корозія, плямами або точкова (піттінг)? |
Fe + О2 + 2Н2О  Fе2+ + K3 [Fe(CN)6 ]
Fе2+ + K3 [Fe(CN)6 ] 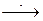
| ||
| 2.1 2.2 2.3 | Дослід №2 Контактна корозія - У пробірку налийте один мл розчину сульфатної кислоти і опустіть одну гранулу цинку. Спостерігайте за швидкістю розчинення цинку. Напишіть рівняння хімічної реакції. - Через одну хвилину до гранули цинку, що знаходиться в розчині Н2SО4 доторкніться мідним дротом. Чому розчинення цинку стало інтенсивнішим? Напишіть схему ГЕ, рівняння реакції,зробіть висновки. - Додайте до гранули цинку, що знаходиться в розчині Н2SО4кілька краплин розчину СuSО4. Чому розчинення цинку стало інтенсивнішим? Напишіть рівняння реакції,зробіть висновки. |
Zn+Н2SО4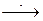 Zn+Н2SО4 + Сu (мідний дріт)
Zn+Н2SО4 + Сu (мідний дріт) 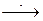 Схема ГЕ:
Процеси:
А:
К:
ЕРСтеор.=
Схема ГЕ:
Процеси:
А:
К:
ЕРСтеор.= 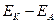 =
Zn+Н2SО4+СuSО4 =
Zn+Н2SО4+СuSО4 Схема:
Процеси:
Схема:
Процеси:
| |
| 3.1 3.2 | Дослід№3 Корозія при порушенні анодного та катодного покриттів. У два стаканчики налийте розчин спецреактиву (Натрій хлориду і червоної кров'яної солі). - У перший стаканчик опустіть пластинку оцинкованого заліза з нанесеними на ній глибокими подряпинами. - У другий стаканчик опустіть пластинку лудженого заліза, теж з подряпинами. У якому стакані іржавіє залізо? Чому? Складіть схеми ГЕ, рівняння анодних і катодних корозійних процесів в кожному випадку. | Оцинковане залізо
Схема:
Процеси:
А:
К:
ЕРСтеор.= 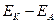 = =
| Луджене залізо
Схема:
Процеси:
А:
K:
ЕРСтеор.= 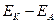 = =
|
| Дослід№4 Атмосферна корозія в результаті різного доступу кисню. Візьміть залізну пластинку і наждачним папером зачистіть на ній невелику ділянку. Обполосніть її водою і обсушіть її фільтрувальним папером. На зачищену ділянку нанесіть краплю спеціального реактиву що складається з 3%NaCl , К3[Fе(СN)6] тафенолфталеїну. Через 3-5 хвилин у центрі краплі з’явиться синій колір, а скраю її - рожеве або малинове забарвлення. Поясніть появу цих забарвлень. Складіть схему утвореної гальванопари. Запишіть рівняння реакції, зробіть висновок. |
Схема ГЕ:
Процеси:
А:
К:
ЕРСтеор.= 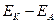 =
Чому в центрі краплі з’явилось синє забарвлення? Напишіть рівняння реакції
Чому з’явилось рожеве забарвлення по краях краплі? =
Чому в центрі краплі з’явилось синє забарвлення? Напишіть рівняння реакції
Чому з’явилось рожеве забарвлення по краях краплі?
|
Висновки і місце для домашніх задач:
Оцінка___________ Дата____________ Підпис викладача____________
Лабораторна робота №