Щоб виконати роботу, Ви повинні знати!
1. Електроліз – це окисно-відновний процес, що протікає за умови пропускання постійного електричного струму через розплав або розчин електроліту.
2. Анод – це електрод, на якому відбувається процес окиснення (тобто віддача електронів).
3. Катод – це електрод, на якому відбувається процес відновлення (тобто приєднання електронів).
4. Порядок окиснення йонів або атомів на аноді: в першу чергу окиснюються частинки з меншим значенням електродного потенціалу.
5. Порядок відновлення йонів або молекул на катоді: в першу чергу відновлюються частинки з більшим значенням
електродного потенціалу.
6. Закони Фарадея:
Перший закон Фарадея: маси речовин, що виділилися на електродах, прямопропорційні кількості електрики (Q),
яка пройшла через розчин або розплав електроліту.
m=k•Q
m – маса речовини, яка виділяється на електродах (г)
Q-кількість електрики, Q=I•t (Кл)
I-сила струму (А)
t-тривалість електролізу (с)
k-електрохімічний еквівалент 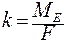
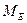 – молярна маса еквівалента (г/моль);
– молярна маса еквівалента (г/моль); 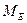 =M/B
=M/B
M – молярна маса (г/моль); B – валентність 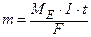 ;
; 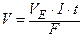 ;
; 
V – об'єм речовини (л)
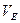 - еквівалентний об'єм (л/моль);
- еквівалентний об'єм (л/моль);
F – число Фарадея (96500 Кл/моль; 26,8 А·годину/моль)
Другий закон Фарадея: у разі проходження через різні електроліти однакової кількості електрики на електродах
виділяються маси речовин, пропорційні молярним масам їх еквівалентів. Хімічні еквіваленти
пропорційні електрохімічним.
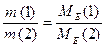
7. Вихід за струмом (h):
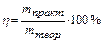
8.Гальваностегія - це нанесення за допомогою електролізу металевих покриттів з метою захисту від корозії, зміцнення поверхні,
декоративного, антифрикційного відновлення розмірів деталей тощо. Наприклад, покриття хромом, нікелем, цинком.
9. Гальванопластика- це процес отримання точних металевих копій з рельєфних предметів електроосадженням металу (на алюмінієву
форму наносять електролізом шар міді потрібної товщини, потім алюміній розчиняють в хлоридній кислоті або в
розчині лугу, з якими мідь не реагує).
10. Електролітичне рафінування. З чорнового металу виготовляють активні(розчинні) аноди, під час електролізу домішки, що присутні в
чорновому металі анода, випадають в осад у вигляді анодного шламу (Cu, Ni, Sn, Pb, Ag, Au), а чистий метал
виділяється на катоді.
Література:
[1] с. 84-90; [2] с. 240-257; [3] с. 198-204; [4] с. 192-195; [5] с. 168-174
Дайте відповіді на запитання:
| 1. Визначить поняття «Електроліз» | |
| 2. Визначить поняття «Анод» | |
| 3. Визначить поняття «Катод» | |
| 4. Що означає поняття «вихід за струмом»? | |
| 5. Який порядок відновлення йонів на катоді? | |
| 6. Який порядок окиснення йонів на аноді? | |
| 7. Чому в гальванічних елементах анод заряджений негативно, а під час електролізу – позитивно? | |
| 8. Чому електродний потенціал води на катоді складає -0.83В, а на аноді = +1.23В ? |