Завдання для самостійної роботи
1. Електроліз розчину K2SO4 проводили струмом силою 5 А протягом 3 годин. Складіть електронні рівняння процесів, що протікають на електродах. Яка маса води при цьому розклалася і чому дорівнюють об'єми газів, що виділилися на катоді і аноді?
Відповіді: 5,03 г; 6,266 л; 3,133 л.
2. Під час електролізу солі деякого металу протягом 1,5 години струмом силою 1,8 А на катоді виділилося 1,75 г цього металу. Визначте молярну масу еквівалента металу. Назвіть цей метал (В=3). Відповідь: 17,37 г/моль.
3. Під час електролізу розчину CuSO4 на аноді виділилося 168 см3 газу (н.у.). Складіть електронні рівняння процесів, що відбуваються на електродах, та визначте, яка маса міді виділилася на катоді. Відповідь: 0,953 г.
5. Електроліз розчину Na2SO4 проводили протягом 5 годин струмом силою 7 А. Складіть електронні рівняння процесів, що відбуваються на електродах. Яка маса води розклалася, і чому дорівнюють об'єми газів (н.у.), що виділилися на катоді і аноді? Відповіді: 11,75 г; 14,62 л; 7,31л.
6. Виконайте роботу та заповніть лабораторний журнал:
Дотримуйтесь правил техніки безпеки! ! (стор5)
| № | Зміст роботи | Рівняння реакцій, спостереження, розрахунки |
| Дослід 1 Електроліз розчину Натрій сульфату. У U-подібну трубку налийте розчин Натрій сульфату. Додайте у кожне коліно 2-3 краплі розчину лакмусу. Потім занурити в розчин графітові електроди. Включіть випрямляч струму і пропускайте струм протягом 5-10 хвилин. Складіть схему електролізу, рівняння електродних реакцій, визначте маси лугу, кислоти та об’єми газів, якщо I=6 A; t = 10 хвилин. | Рівняння дисоціації: Na2SO4 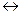 2Na+ +SO42-
Процеси: H2O
(-) K (+) A
Na+ ( 2Na+ +SO42-
Процеси: H2O
(-) K (+) A
Na+ (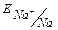 = -2.71B) SO42- ( = -2.71B) SO42- (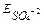 =2.01B)
H2O ( =2.01B)
H2O (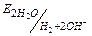 =-0.83В) H2O ( =-0.83В) H2O (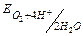 =+1.23В) =+1.23В)
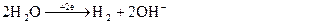 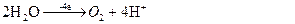
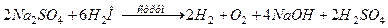    Розрахунки :
m(NaON)=
m(H2SO4)=
V(H2)=
V(O2)=
Розрахунки :
m(NaON)=
m(H2SO4)=
V(H2)=
V(O2)=
| |
| Дослід 2 Електроліз розчину Калій йодиду. Налийте в U - подібну трубку розчин Калій йодиду, та 3 краплі фенолфталеїну Проведіть електроліз з графітовими електродами. Визначте масу Калій йодиду при I=6 A; t = 10 хвилин. Як можно довести утворення йоду? | Рівняння дисоціації: Процеси: (-) К (+) А Розрахунки: | |
| Дослід 3 Електроліз розчину Купрум(П) хлориду. Налийте в електролізер розчин Купрум(П) хлориду та проведіть електроліз. Визначте масу речовини на катоді та об’єм газу на аноді (I=6 A; t = 10 хвил.), якщо вихід за струмом складає 70%. Додайте розчин KI. Що спостерігаєте? Напишіть рівняння реакції. | Рівняння дисоціації: Процеси: (-) К (+) А Розрахунки: | |
Дослід 4.
Електроліз розчину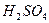 з мідним анодом. Залийте в U-подібну трубку розчин з мідним анодом. Залийте в U-подібну трубку розчин 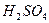 . Графітовий електрод приєднайте до катода, а мідний - до анода і проведіть електроліз. Складіть рівняння катодної та анодної реакцій. Поясніть і зробіть висновок про застосування такого методу електролізу.
Визначте масу або об’єм речовин, що виділяються на електродах (І=5А, t=5хвил.) . Графітовий електрод приєднайте до катода, а мідний - до анода і проведіть електроліз. Складіть рівняння катодної та анодної реакцій. Поясніть і зробіть висновок про застосування такого методу електролізу.
Визначте масу або об’єм речовин, що виділяються на електродах (І=5А, t=5хвил.)
| Рівняння дисоціації: Процеси: (-) К (+) А(Си - мідний) Розрахунки: |
Висновки і місце для домашніх задач:
Оцінка___________ Дата____________ Підпис викладача___________