Це цікаво!
Ø Прочитайте цей вірш, він допоможе вам запам’ятати різницю між екзо- та ендотермічними реакціями:
Займёмся реакциями химическими. Эндо — тепло подавай скорей,
Экзотермическими и эндотермическими. Как в дом зимой тепло батарей.
Они, как противники энергетические. Экзо — тепло само принесло,
Экзотермические и эндотермические. Как будто бы лето к тебе пришло
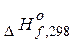 - стандартна ентальпія утворення речовини.(Дивись табл. 2, с. 19)
- стандартна ентальпія утворення речовини.(Дивись табл. 2, с. 19)
Наприклад: 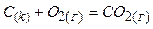 ;
; 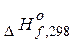
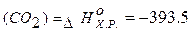 кДж/моль.
кДж/моль.
У нашому прикладі: 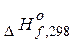
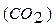 - стандартна ентальпія утворення Карбон (IV) оксиду дорівнює
- стандартна ентальпія утворення Карбон (IV) оксиду дорівнює 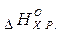 - зміні ентальпії реакції утворення I моль речовини (
- зміні ентальпії реакції утворення I моль речовини (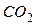 ) з простих речовин. У нашому прикладі
) з простих речовин. У нашому прикладі 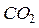 утворюється з простої речовини вуглецю (С) і простої речовини кисню (
утворюється з простої речовини вуглецю (С) і простої речовини кисню (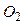 ) за стандартних умов.
) за стандартних умов.
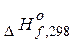 - стандартна ентальпія утворення простих речовин дорівнює нулю!
- стандартна ентальпія утворення простих речовин дорівнює нулю!
- Закон Гесса: тепловий ефект хімічної реакції (тобто зміна ентальпії системи під час хімічної взаємодії) залежить тільки від енергетики початкового і кінцевого стану речовин, що беруть участь у реакції, і не залежить від проміжних стадій процесу.
- Наслідок закону Гесса: Тепловий ефект (зміна ентальпії) реакції
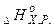 =різниці між сумою ентальпій утворення продуктів реакції (
=різниці між сумою ентальпій утворення продуктів реакції (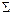
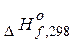 прод.) і сумою ентальпій утворення вихідних речовин (
прод.) і сумою ентальпій утворення вихідних речовин (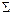
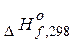 вих. реч.) з урахуванням стехіометричних коефіцієнтів.
вих. реч.) з урахуванням стехіометричних коефіцієнтів.
Закон Гесса дозволяє обчислити тепловий ефект хімічної реакції:
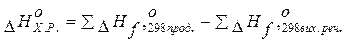
Література: [1] с. 24-37; [2] с. 137-153; [3] с. 111-117; [4] с. 88-116; [5] с. 66-74