II-й закон термодинаміки: .
2.S – ентропія –це термодинамічна функція стану системи, яка є мірою невпорядкованості системи.
3. У разіізольованої системи 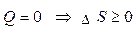 , у цьому випадку:зміна ентропії не залежить від температури і теплоти та є
, у цьому випадку:зміна ентропії не залежить від температури і теплоти та є
однозначним критерієм можливості самодовільного перебігу процесу.
Якщо в ізольованій системі ентропія зростає (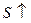 ), то процес здійснюється самовільно!
), то процес здійснюється самовільно!
4. 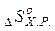 -зміну ентропії хімічної реакції можна розрахувати таким же чином, як ми розраховували тепловий ефект хімічної реакції за наслідком закону Гесса:
-зміну ентропії хімічної реакції можна розрахувати таким же чином, як ми розраховували тепловий ефект хімічної реакції за наслідком закону Гесса: 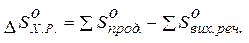
5.Об’єднані I-ий та II-й закони термодинаміки для 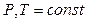 або рівняння Гіббса Гельмгольца:
або рівняння Гіббса Гельмгольца: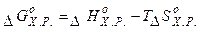
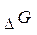 -це та частина зміни ентальпії, котра може використовуватися для виконання корисної роботи.
-це та частина зміни ентальпії, котра може використовуватися для виконання корисної роботи.
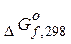 -стандартна вільна енергія утворення речовини, вона дорівнює зміні енергії Гіббса у разі утворення 1 моля речовини за стандартних умов.
-стандартна вільна енергія утворення речовини, вона дорівнює зміні енергії Гіббса у разі утворення 1 моля речовини за стандартних умов.
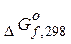 простих речовин дорівнює нулю.
простих речовин дорівнює нулю.
6. Зміну енергії Гіббса хімічної реакції (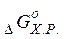 ) можна обчислити таким же чином, як ми розраховували
) можна обчислити таким же чином, як ми розраховували 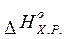
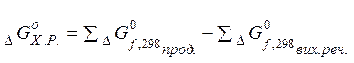
7. Величина зміни енергії Гіббса вказує спрямованість процесу:
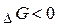 - реакція можлива за будь-яких умов;
- реакція можлива за будь-яких умов;
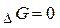 - реакція знаходиться в стані динамічної рівноваги;
- реакція знаходиться в стані динамічної рівноваги;
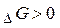 - реакція не здійснюється самодовільно.
- реакція не здійснюється самодовільно.
Запитання для самоконтролю
1.Напишіть математичний вираз другого закону термодинаміки.
2.Напишіть рівняння Гіббса-Гельмгольца.
3.Назвіть однозначний критерій можливості самодовільного протікання процесу в ізольованих системах.
4.Назвіть однозначний критерій можливості самодовільного протікання процесу в закритих системах у разі 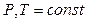 .
.
5.Чи буде самодовільно протікати реакція, якщо 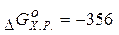 кДж?
кДж?
6.Чому дорівнює 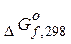 утворення простих речовин?
утворення простих речовин?