Завдання для самостійної роботи
.
Розрахуйте стандартний тепловий ефект реакцій і зробіть висновок: як вони протікають з виділенням або поглинання тепла?
1) 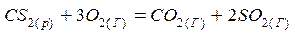 ;
;
2) 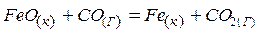 ;
;
3) 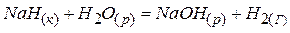 ;
;
4) 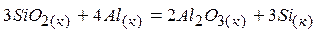 .
.
Самостійно вирішити задачі № 283, 288, 300, 303, 311 [5. с. 75-78]
Таблиця 2. ТЕРМОДИНАМІЧНІ КОНСТАНТИ ДЕЯКИХ СПОЛУК
| Сполука | Агрегатний стан | 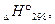 кДж/моль кДж/моль
| 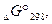 кДж/моль
кДж/моль
| 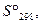 Дж/(моль К)
Дж/(моль К)
| Сполука | Агрегатний стан | 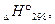 кДж/моль кДж/моль
| 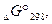 кДж/моль
кДж/моль
| 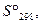 Дж/(моль К)
Дж/(моль К)
|
| AI | к | 42,7 | KCl | к | -435,9 | -408,0 | 82,6 | ||
| AI2О3 | к | -1669,8 | -1582,0 | 50,9 | КНSO4 | к | -1158,1 | -1043,5 | 187,9 |
| Al2(SО4)3 | к | -3434 | -3091,9 | 239,2 | К2SO4 | к | -1433,4 | -1316,4 | 175,7 |
| ВаО | к | -556,6 | -528,4 | 70,3 | КNO3 | к | -492,7 | -393,1 | 133,0 |
| ВаСОз | к | -1202,0 | -1138,8 | 112,1 | MgO | к | -601,2 | -569,6 | 26,9 |
| ВеО | к | -598,7 | -581,6 | 14,1 | MgCO3 | к | -1096,2 | -1029,3 | 65,7 |
| ВеСОз | к | -981,6 | -944,8 | 199,4 | N2 | г | 191,5 | ||
| С(графіт) | к | 5,7 | NH3 | г | -46,2 | -16,7 | 192,5 | ||
| СаО | к | -635,5 | 604,2 | 39,7 | NH4NO3 | к | -365,4 | -183,8 | |
| СаСО3 | к | -1207,0 | -1127,7 | 88,7 | NH4Cl | к | -315,4 | -203,7 | 94,5 |
| Са (ОH)2 | к | -986,2 | -896,76 | 83,4 | NO | г | +90,4 | +86,7 | 210,2 |
| Са3 (PО4)2 | г | -4125,0 | -3899,5 | 240,9 | N2O | г | +81,6 | +103,6 | 220,0 |
| СО | г | -110,5 | -137,3 | 197,9 | NO2 | г | +33,5 | +51,5 | 240,2 |
| CO2 | г | -393,5 | -394,4 | 213,6 | N2O4 | г | +94,0 | +98,3 | 304,3 |
| СОСl2 | г | -220,3 | -266,9 | 283,9 | N2O3 | г | +83,8 | +307,0 | 140,5 |
| СН4 | г | -74,8 | -50,7 | 186,2 | NaH | к | -57,0 | - | - |
| С2Н6 | г | -82,9 | -32,9 | 229,5 | NaOH | к | -469,5 | -377,0 | 64,2 |
| С6Н6 | p | +49 | +124,5 | 173,2 | NaCl | к | -410,9 | -384 | 72,4 |
| С2Н2 | г | +226,8 | +209,2 | 200,8 | NaF | к | - | -541,0 | - |
| С2Н4 | г | +52,3 | +68,1 | 219,4 | Ni | к | 29,87 | ||
| СН3ОН | p | -238,7 | -166,3 | 126,8 | NiO | к | -239,7 | -211,6 | 38,0 |
| C2H5OH | p | -227,6 | -174,8 | 160,7 | O2 | г | 205,0 | ||
| C2H5OH | г | -235,3 | - | - | PH3 | г | +5,4 | +13,4 | 210,23 |
| С6Н12О6 | к | -1273,0 | -919,5 | - | P2O5 | к | -1492,0 | -1348,8 | 114,5 |
| СS2 | p | +115,3 | +65,1 | 237,8 | POCl3 | p | -597,1 | -521,3 | 222,5 |
| Сl2 | г | 222,9 | PCl5 | г | -277 | -286,3 | 352,7 | ||
| Cu | к | 33,3 | PCl3 | г | -369,4 | -324,6 | 311,6 | ||
| CuO | к | -162,1 | -129,9 | 42,6 | Pb | к | 64,9 | ||
| Cu(NO3) 2 | к | -307,11 | -114,22 | 193,3 | PbO | к | -219,3 | -189,1 | 66,1 |
| Сг2О3 | к | -1141,0 | -1046,8 | 81,1 | PbO2 | к | -276,6 | -219 | 76,4 |
| Fe | к | 27,2 | PbCl2 | к | -359,8 | 82,6 | -408,0 | ||
| FeO | к | -264,8 | -244,3 | 60,8 | S(ромб) | к | 31,9 | ||
| Fe2O3 | к | -822,1 | -740,3 | 87,4 | SO2 | г | -296,9 | -300,2 | 248,1 |
| Fe3O4 | к | -1117,1 | -1014,2 | 146,2 | SO3 | г | -395,2 | -370,4 | 256,2 |
| H2 | г | 130,6 | Si | к | 18,8 | ||||
| H2O | г | -241,8 | -238,6 | 188,7 | SiO2 | к | -910,9 | -856,7 | 41,8 |
| H2O | p | -285,8 | -237,2 | 69,9 | SnO2 | к | -580,8 | -519,65 | 52,3 |
| H2O2 | p | -187,4 | -117,6 | 105,9 | SrO | к | -590,4 | -559,8 | 54,4 |
| HCl | г | -92,3 | -95,2 | 186,7 | SrCO3 | к | -1221,3 | -1137,6 | 97,1 |
| H2S | г | -20,2 | -33,8 | 205,6 | Ti | к | 30,7 | ||
| H2SO4 | p | -811,3 | -742,0 | 156,9 | TiO2 | к | -943,9 | -888,5 | 50,3 |
| Hg | к | 76,1 | Zn | к | 41,63 | ||||
| Hg2Cl2 | к | -264,8 | -210,7 | 195,8 | ZnO | к | -350,6 | -320,7 | 43,6 |
| HgCl2 | к | -230,1 | -185,8 | 144,4 |
Виконайте експеримент та заповніть лабораторний журнал:
Дотримуйтесь правил техніки безпеки! (стор.5)
Питома вага розчинів: 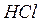
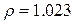 г/мл;
г/мл; 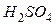
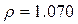 г/мл;
г/мл; 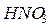
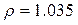 г/мл;
г/мл; 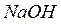
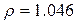 г/мл;
г/мл; 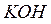
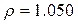 г/мл.
г/мл.
| № | Зміст роботи | Рівняння реакцій, спостереження, розрахунки | |||
З бюреток відміряйте у стаканчики по 25 мл розчинів:
· У один стаканчик з бюретки налийте 25 мл розчину кислоти, а у другий – 25 мл розчину лугу.
· Вставте воронку в боковий отвір внутрішньої посудини калориметра та обережно перелийте в нього із стаканчика розчин кислоти.
· Запишіть температуру розчину кислоти з точністю до 0,10 (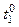 ).
· Влийте за допомогою воронки у калориметр розчин лугу.
· Обережно та старанно перемішайте мішалкою розчин. Слідкуйте за підвищенням температури до тих пір, поки вона не почне падати.
· Запишіть максимальну температуру розчину ( ).
· Влийте за допомогою воронки у калориметр розчин лугу.
· Обережно та старанно перемішайте мішалкою розчин. Слідкуйте за підвищенням температури до тих пір, поки вона не почне падати.
· Запишіть максимальну температуру розчину (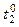 ). ).
|
Рівняння реакції:
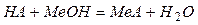 ; ;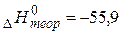 кДж/моль кДж/моль
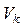 - (об’єм кислоти) =______мл - (об’єм кислоти) =______мл
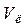 - (об’єм лугу) =_________мл - (об’єм лугу) =_________мл
 - питома вага розчину кислоти =______г/мл - питома вага розчину кислоти =______г/мл
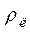 - питома вага розчину лугу = ________ г/мл - питома вага розчину лугу = ________ г/мл
| ||||
| Розрахуйте маси кислоти, лугу та масу всього розчину |
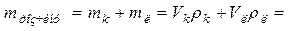 ______мл ______мл
| ||||
| Обчисліть кількість тепла (q) | 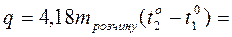 ______Дж ______Дж
| ||||
| Перерахуйте теплоту q на 1 еквівалентну масу кислоти | 1. Знаходимо кількість 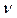 еквівалентів у 25 мл розчину еквівалентів у 25 мл розчину
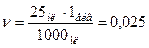 еквівалентів
2. еквівалентів
2. 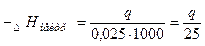 (кДж) (кДж)
| ||||
Розрахуйте відносну похибку визначення теплоти реакції нейтралізації 
| 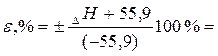 ______% ______%
| ||||
Висновки і місце для домашніх задач:
Оцінка__________ Дата___________ Підпис викладача____________