рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Направленность ковалентной связи
Реферат Курсовая Конспект
Направленность ковалентной связи
Направленность ковалентной связи - раздел Химия, Общая химия Согласно Мвс Наиболее Прочные Химические Связи Возникают В На...
Согласно МВС наиболее прочные химические связи возникают в направлении максимального перекрывания атомных орбиталей. Поскольку атомные орбитали имеют определённую форму, их максимальное перекрывание возможно при определённой пространственной ориентации, поэтому ковалентная связь характеризуется направленностью. Иначе говоря, направленность заключается в том, что максимальное перекрывание валентных электронных облаков взаимодействующих атомов возможно при определенной их взаимной ориентации. Направленность ковалентной связи определяет пространственную конфигурацию молекул.
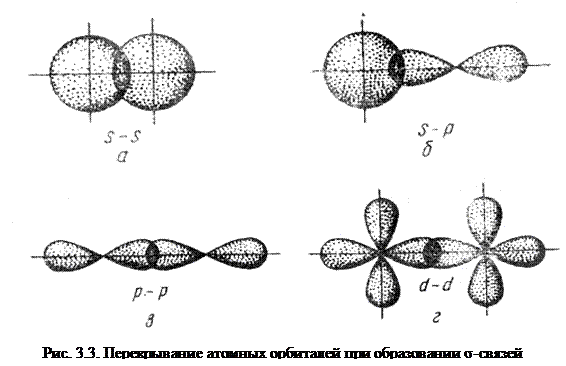
В зависимости от направления перекрывания атомных орбиталей различают σ -, π – и δ – связи.
Связь, образованная перекрыванием АО по линии, соединяющей ядра взаимодействующих атомов, называется σ – связью. Сигма-связь может возникать при перекрывании s – орбиталей (рис. 3.3,а), s – , p – орбиталей (рис. 3.3,б), р – орбиталей (рис. 3.3,в), d – орбиталей (рис. 3.3,г), а также d – и s – орбиталей, и f – орбиталей с друг другом и другими орбиталями. Сигма – связь обычно охватывает два атома и не простирается за их пределы, поэтому является локализованной двухцентровой связью.
Простейший случай σ – связи наблюдается у молекулы Н2, образующейся за счет перекрывания s-орбиталей атомов водорода (s-s перекрывание, рис. 3.4). Геометрическая форма молекулы линейная.
Рассмотрим образование молекулы HCl.
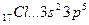

3s 3p 3d
3s 3p 3d
Исходя из стехиометрического состава молекулы HCl и валентности водорода, равной единице, мы видим, что хлор, находясь в невозбужденном состоянии, проявляет валентность В=1 (в возбужденном состоянии хлор проявляет валентности 3, 5, 7). При образовании молекулы HCl происходит перекрывание s – орбитали атома водорода с р – орбиталью атома хлора (s – р перекрывание). Молекула имеет линейную форму (рис. 3.5). Очевидно, такие же линейные молекулы должны образовать с водородом аналоги 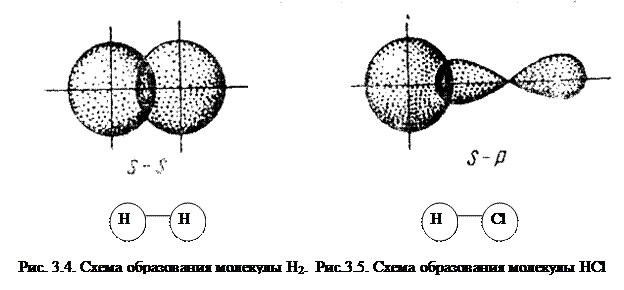 хлора – бром, йод, астат.
хлора – бром, йод, астат.
Связь, образованная перекрыванием АО по обе стороны линии, соединяющей ядра атомов (боковые перекрывания), называется π-связью. Пи-связь может образовываться при перекрывании р – р-орбиталей (рис. 3.6, a), p – d-орбиталей (рис. 3.6,б), d – d-орбиталей (рис. 3.6,в), а также f – p-, f – d- и f – f-орбиталей.
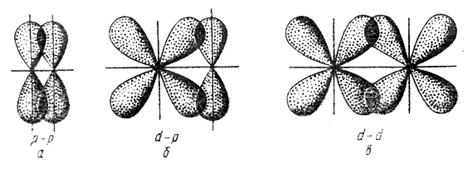 |
Рис. 3.6 . Перекрывание атомных орбиталей при образовании π-связей
Связь, образованная перекрыванием d-орбиталей всеми четырьмя «лепестками» называется δ-связью (дельта-связью, рис. 3.7).
Соответственно, s-элементы могут образовывать только σ-связи, р-элементы – σ- и π-связи, d-элементы – σ-, π- и δ-связи, а f-элементы – σ-, π-, δ- и еще более сложные связи. В связи с меньшим перекрыванием АО прочность у π- и δ-связей ниже, чем у σ-связей.

Рис. 3.7. Направления перекрывания атомных d – орбиталей при образовании δ-связей
Кратность связи. Связь, которая образована одной электронной парой между двумя атомами, называется одинарной. Одинарная связь всегда σ – связь. Химическая связь может осуществляться более чем одной парой электронов. Связь, образованная более чем одной электронной парой, называется кратной (двойной или тройной), которая образуется при наложении σ -, π – и δ – связей. В кратных связях одна из связей обязательно является σ – связью.
При наложении π-связи на σ-связь образуется двойная связь, например в молекулах кислорода, этилена, диоксида углерода.
/
Кратная связь изображается двумя черточками: О =О, С = С, О = С = О.
/
Хотя энергия π-связи меньше, чем энергия σ-связи, однако суммарная энергия двойной связи выше энергии одинарной связи, а длина двойной связи меньше длины одинарной связи.
При наложении двух π-связей на σ-связь возникает тройная связь, например в молекулах азота, ацетилена и оксида углерода. Тройная связь изображается тремя черточками: N ≡ N, ─ C ≡ C ─, C ≡ O. Энергия тройной связи выше, а длина связи ниже, чем энергии и длины простой и двойной связей.
Число связей между атомами в МВС называется кратностью связи. Примером образования кратной связи может служить молекула азота N2.
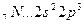 В=3
В=3 
2s 2p
На рис. 3.8,а показано расположение в пространстве р - орбиталей в двух атомах азота. В молекуле азота рх – орбитали образуют одну σ-связь (рис. 3.8,б). При образовании связи рz – орбиталями (рис. 3.8,в) возникают две области перекрывания – выше и ниже оси Х, т. е. образуется π – связь. Вторую π – связь в молекуле азота образуют ру – орбитали атомов (рис. 3.8,г). Молекула N2 линейна. Таким образом, пространственное расположение σ – связей определяет пространственную конфигурацию молекул.
 В некоторых молекулах и ионах, содержащих двойные связи, π-связи являются делокализованными, т. е. охватывающими не два атома, а часть или целые молекулы или ионы. Например, структура молекулы 1, 3-бутадиена может быть записана в двух формах:
В некоторых молекулах и ионах, содержащих двойные связи, π-связи являются делокализованными, т. е. охватывающими не два атома, а часть или целые молекулы или ионы. Например, структура молекулы 1, 3-бутадиена может быть записана в двух формах:
 СН2 = СН – СН = СН2 и СН2 – СН = СН – СН2
СН2 = СН – СН = СН2 и СН2 – СН = СН – СН2

В действительности в чистом виде не существует ни та, ни другая структура, а гибридная структура, в которой π – электроны не принадлежат двум конкретным атомам, а всей молекуле в целом. Пи-связи в молекулах или ионах, у которых возможно несколько способов локализации связей между атомами, называются делокализованными связями, обозначаемыми пунктиром:

Приведенная структура называется резонансной.
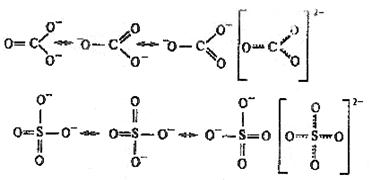
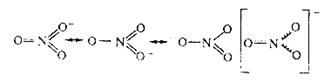 Другими примерами соединений с делокализованными связями служат молекула озона О3, бензола С6Н6, а также ионы NO3‾, СО32-, SO42-:
Другими примерами соединений с делокализованными связями служат молекула озона О3, бензола С6Н6, а также ионы NO3‾, СО32-, SO42-:
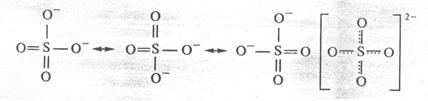
Пространственные формы молекул весьма разнообразны. Так, молекула СО2 имеет линейную структуру, молекула СН4 – тетраэдрическую, молекула NH3 – пирамидальную, воды – угловую, SO3 – треугольную.
Для объяснения пространственной конфигурации молекул используется модель (теория) гибридизации атомных орбиталей.
Гибридизация атомных орбиталей.В молекуле метана СН4 существуют четыре связи С – Н, имеющие одинаковые длины и энергии. Между тем у углерода в возбужденном состоянии имеются три р- и одна s-орбитали с неспаренными электронами, которые перекрываются s-орбиталями водорода. Исходя из этого, можно было бы ожидать, что характеристики одной из связей в молекуле метана будут отличаться от характеристик других связей. В действительности, все четыре связи в молекуле метана равноценны.
Для объяснения данного факта американский ученый Л. Полинг разработал теорию о гибридизации атомных орбиталей. Основные положения теории гибридизации АО:
1. Если у атома, вступающего в химическую связь, имеются разные АО (s-, р-, d- или f-АО), то в процессе образования химической связи происходит гибридизация (смешение) АО, т.е. из разных АО образуются одинаковые (эквивалентные) АО. Следует подчеркнуть, что гибридные АО образуются у одного атома, имеющего разные орбитали. Причем гибридизация происходит у орбиталей, имеющих близкие значения энергии.
Иначе говоря, гибридизация – выравнивание по форме и энергии АО (облаков) с образованием новых АО, одинаковых по форме и энергии. Новые облака называются гибридными, их число равно сумме АО, участвующих в гибридизации.
Следует отметить, что как физический процесс, гибридизация орбиталей не существует. Теория гибридизации АО – это удобный и наглядный прием описания сложных процессов, происходящих при образовании химических соединений.
2. Форма гибридной АО отличается от формы исходных АО (рис. 3.9). В гибридной АО электронная плотность смещается в одну сторону от ядра, поэтому при взаимодействии ее с АО другого атома происходит максимальное перекрывание, которое приводит к повышению энергии связи. Это повышение энергии связи компенсирует энергию, требуемую на образование гибридной орбитали. В результате химические связи, образованные гибридными орбиталями, прочнее, а полученная молекула более устойчива.
Пространственная конфигурация молекул. Характер гибридизации валентных орбиталей центрального атома и их пространственное расположение определяют пространственную конфигурацию (геометрическую форму) молекул:
1. Если в химическую связь вступает атом, у которого на внешней оболочке имеется s- и р – электроны, то у данного атома в процессе образования связи происходит sp – гибридизация АО (рис. 3.10).
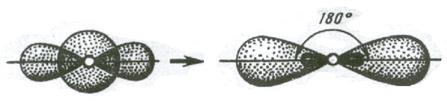
(s+p) орбитали Две sp – орбитали
Рис. 3.10. Схема sp – гибридизации
Две sp – гибридные орбитали расположены симметрично под углом 180˚, отсюда и связи, образуемые с участием электронов этих орбиталей, также располагаются под углом 180˚. Например, у атома бериллия sp – гибридизация орбиталей проявляется в молекуле BeCl2, которая вследствие этого имеет линейную форму (рис. 3.13,а)
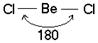
s-p – гибридизация характерна для атомов элементов II группы периодической системы (Be, Mg, Cd, Hg и т. д.), для углерода в СО2, в органических соединениях с тройной углерод – углеродной связью.
2. Если у атома, вступающего в химическую связь, на внешней оболочке имеется один s- и два p- электрона, то происходит sp2 – гибридизация АО орбиталей этого атома (рис. 3.11).
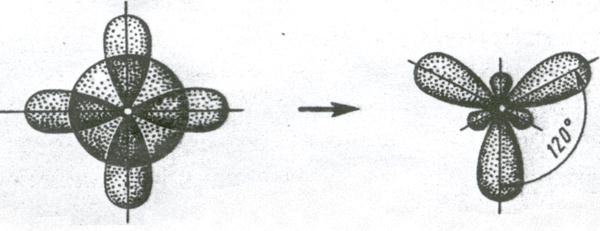 (s+p+p) – орбитали Три sp2 – орбитали
(s+p+p) – орбитали Три sp2 – орбитали
Рис. 3.11 . Схема sp2 – гибридизации
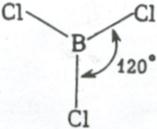
Три sp2 – гибридные орбитали расположены под углом 120˚. Под таким же углом располагаются и связи, образованные с участием электронов этих орбиталей. Например, вследствие sp2 – гибридизации орбиталей атома бора молекула BCl3 имеет треугольную форму (рис. 3.13, б). Распределение химических связей можно представить следующей схемой:
sp2 – гибридизация встречается в молекулах элементов III группы периодической системы, а также в органических соединениях с двойной углерод – углеродной связью.
3. У атома, имеющего на внешней оболочке один s- и три р- электрона, при химическом взаимодействии происходит sp3 – гибридизация этих АО (рис. 3.12).
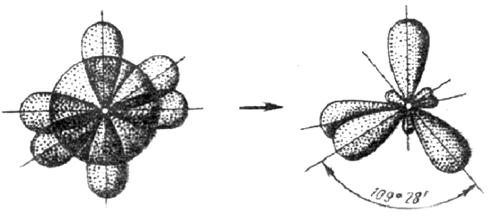
(s+p+p+p) – орбитали Четыре sp3 – орбитали
Рис. 3.12. Схема sp3 – гибридизации
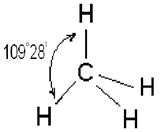
Четыре sp3 – гибридные орбитали симметрично ориентированы в пространстве под углом 109˚28′ к четырем вершинам тетраэдра (рис. 3.13, в). Тетраэдрическое расположение связей и форма тетраэдра характерны для элементов IV группы, в том числе для многих соединений углерода, например, CH4:
4. Возможны также более сложные виды гибридизации с участием d- и f- орбиталей атомов, при которых образуются молекулы ещё более сложной конфигурации.
Комбинация орбиталей типа одной s-, трех р- и одной d- приводит к sp3d-гибридизации. Это соответствует пространственной ориентации пяти sp3d-гибридных орбиталей к вершинам тригональной бипирамиды (рис. 3.13, г). В случае sp3d2-гибридизации шесть sp3d2-гибридных орбиталей ориентируются к вершинам октаэдра (рис. 3.13, д). Ориентация семи орбиталей к вершинам пентагональной бипирамиды (рис. 3.13, е) соответствует sp3d3 (или sp3d2f) – гибридизации валентных орбиталей центрального атома молекулы (комплекса).
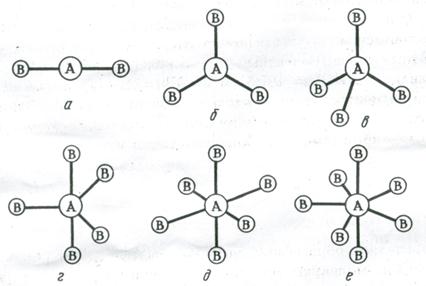
Рис. 3.13. Пространственное расположение связей и конфигурация молекул:
а – линейная; б – треугольная; в – тетраэдрическая; г – тригонально-бипирамидальная; д – октаэдрическая; е – пентагонально-бипирамидальная
Влияние несвязывающей электронной пары центрального атома на строение молекул. Рассмотренная выше теория гибридизации орбиталей центрального атома (обозначен в общих формулах через А) применима к большому количеству молекул и ионов. Однако для ряда молекул и ионов, особенно имеющих несимметричное строение, рассмотренных представлений оказывается недостаточно. В подобных случаях применяют теорию полной гибридизации (Джиллеспи), в которой и связывающие, и неподеленные электронные пары центрального атома подвергаются sp3 – гибридизации. sp3 – гибридизация центральных атомов имеет место в молекулах NH3, H2O и им подобным, образованным их электронными аналогами.
У атома азота на четыре sp3 – гибридные орбитали приходятся пять электронов.
 7N
7N  sp3-гибридизация
sp3-гибридизация
2s 2p
Следовательно, одна пара электронов оказывается несвязывающей и занимает одну из sp3-гибридных орбиталей, направленных к вершине тетраэдра (рис. 3.14). Молекула NH3 имеет форму тригональной пирамиды.
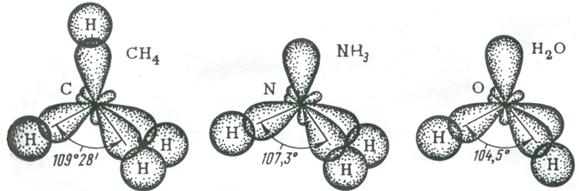
Рис. 3.14. Перекрывание валентных орбиталей в молекулах CH4, NH3, H2O
У атома кислорода на четыре sp3-гибридные орбитали приходится шесть электронов:
8О  sp3-гибридизация
sp3-гибридизация
2s 2p
Теперь уже несвязывающие электронные пары занимают две гибридные sp3-орбитали. Молекула H2O имеет угловую форму (рис. 3.14).
В представлениях теории гибридизации уменьшение валентного угла НЭН в ряду СН4 (109,5˚) – NH3 (107,3˚) – H2O (104,5˚) объясняется следующим образом. В ряду С-N-О энергетическое различие между 2s- и 2р – орбиталями увеличивается, поэтому вклад 2s-орбиталей при гибридизации с 2р-орбиталями уменьшается. Это приводит к уменьшению валентного угла и постепенному приближению его к 90˚.
– Конец работы –
Эта тема принадлежит разделу:
Общая химия
Государственное образовательное учреждение высшего профессионального образования... Тюменский государственный нефтегазовый университет...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Направленность ковалентной связи
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов