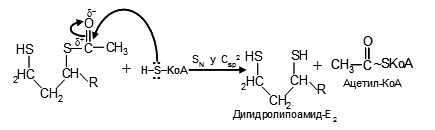Ферменты пируватдегидрогеназного комплекса
| Название фермента-протомера | Обозначение | Простетическая группа | Катализируемая реакция |
| Пируватдегидрогеназа ( декарбоксилирующая) | Е1 | Тиаминдифосфат (ТДФ) | Декарбоксилирование ПВК |
| Дигидролипоилтрансацетилаза (дигидролипоилацетилтрансфераза) | Е2 | Липоамид | Окисление С2- фрагмента и перенос его на HS-KoA |
| Дигидролипоилдегидрогеназа | Е3 | Флавинадениннуклеотид(ФАД) | Регенерация окисленного липоамида |
Этот процесс практически необратим, так как он сопровождается выделением свободной энергии, равной 33,5 кДж. С каталитической целью используется несколько протеинов, работающих в определенной последовательности и объединенных в мультиферментный пируватдегидрогеназный комплекс. Он включает три энзима (табл. 7), каждый из которых является сложным белком.
Простетические группы представлены активными формами витаминов В1 (тиамина) в Е1, В2 (рибофлавина) в Е3 и витаминоподобным соединением (липоамидом) в Е2. В обеспечении нормального хода реакций участвуют и свободные коферменты: окисленный НАД+ и HS- KoA; с помощью первого передается на ЭТЦ восстановительный эквивалент, а второй транспортирует остаток уксусной кислоты в виде ацетил- КоА к системе энзимов цитратного цикла.
Строение пируватдегидрогеназного комплекса довольно сложно: включает до нескольких десятков субъединиц различных моноферментов. Данная система катализаторов характеризуется большим отрицательным редокс-потенциалом, который обеспечивает наряду с восстановлением кофермента (НАДН) образование макроэргической тиоэфирной связи в ацетил-КоА.
Процесс протекает в 4 стадии:
I. Взаимодействие ПВК с ТДФ-Е1: при этом происходит перенос гидроксиэтильной группы на тиазольное кольцо связанного с ферментом тиаминдифосфата. Движущей силой реакции является сродство электроноизбыточного α-положения тиазольного кольца молекулы активированного витамина В1 к элек-
трофильному центру пирувата.
Как видно из схемы, α-углеродный атом вследствие соседства гетероатомов проявляет СН-кислотность; в присутствии пирувата от него отщепляется протон, что превращает его в карбанион, который легко взаимодействует с α-кетокислотой. В образовавшемся промежуточном S-Е1-комплексе происходит смещение π-электронов в сопряженной системе к N+, что облегчает разрыв связи С-С и отщепление СО2:

II. Ионизированная гидроксиэтильная группа получившейся формы ТДФ, взаимодействуя с окисленным липоамидом, преобразуется в ацетиллипоамид–Е2. При этом ТДФ регенерирует, в качестве окислителя выступает -S-S-группа второго фермента:

Амид липоевой кислоты – (витаминоподобное соединение) с помощью амидной связи с аминогруппой лизина включена в состав дигидролипоилтрансацетилазы (Е2). Интересно, что простетическая группа фермента локализуется на конце гибкой цепи (поворотного кронштейна), что позволяет ей легко поворачиваться и взаимодействовать поочередно с Е1 и Е3.
|
IV. Завершается процесс окислением липоамида в реакции с флавопротеином – дигидролипоилдегидрогеназой (Е3). Восстановленный кофермент окисляется НАД+, который в свою очередь передаёт восстановительные эквиваленты на ЭТЦ:
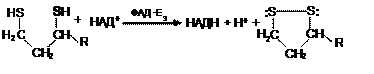
Как видно из схемы, в третьем ферменте роль коэнзима выполняет окисленный ФАД, что иногда заставляет эту стадию раскладывать на две:
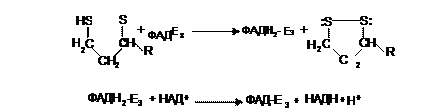
Так как в ЭТЦ передается восстановительный эквивалент НАДН+Н+, что позволяет энергии, выделившейся в цепи, трижды обеспечивать окислительное фосфорилирование, т.е. генерировать три молекулы АТФ.