Цепи митохондрий
| Название | Локализация, состав, функции | Редокс–центры |
| Комплекс I (НАДН – убихинон-редуктаза) | Трансмембранный комплекс из 25 субъединиц. Предназначен для окисления молекул НАДН, продуцируемых растворимыми матриксными дегидрогеназами. | 1 ФМН 4 FeS-белка |
| Комплекс II (сукцинат-убихинон–редуктаза) | Состоит из серии субъединиц, внедренных во внутреннюю мембрану со стороны матрикса; переносит 2ē и 2Н+ от сукцината на мобильный убихинон липидного бислоя. | 1 ФАД 3 FeS-белка 1 гем b |
| Комплекс III (цитохром bc1; убихинон–цитохром–с–редуктаза) | Трансмембранный белок из 11 субъединиц, включает цитохромы b, c1 и FeS-белок. Они образуют цепочку поочередного транспорта каждого электрона от КоQ·Н2 на цитохром с, примыкающего к мембране. | 3 гем b 1 FeS-белок |
| Комплекс IV (цитохромоксидаза) | Ансамбль из 6 субъединиц. Из них каталитическая содержит не только два гема, но и ионы меди (Сu2+В, Сu2+А), она обеспечивает поток электронов от цитохрома c снаружи мембраны на молекулу кислорода в матриксе. | 1 гем а 1 гем а3 1 Сu2+А 1 Сu2+В |
| F0-F1-АТФ-синтаза | Сложная молекулярная машина включает два субкомплекса: факторы F0 и F1 (протонтранспортирующая двухсекторная АТФ–аза). |
Структура НАД+, установленная Г. Эйлер-Хельпиным с соавторами, представляет динуклеотид, в котором мономеры объединены друг с другом ангидридной связью. Одним мононуклеотидом является АМФ, в другом в качестве азотистого основания выступает амид никотиновой кислоты (рис. 6).

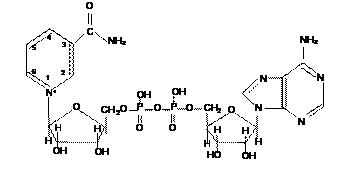
Рис. 6. Строение никотинамидадениндинуклетида (НАД+)
Окисленная форма НАД+ включает в себя катион пиридиния (=N+=), в котором смещается π-электронная плотность сопряженной ароматической системы, делая С4 сильным электрофилом, благодаря этому гидрид ион (Н‾ ) отрывается от субстрата и присоединяется к С4, происходит восстановление. В результате нарушается ароматичность пиридиниевого ядра, следствием чего и является повышение энергии восстановленной формы (НАДН) по сравнению с его окисленной.. Субстрат, лишившись гидрид иона, теряет устойчивость; для стабилизации от него отщепляется протон (рис. 7).
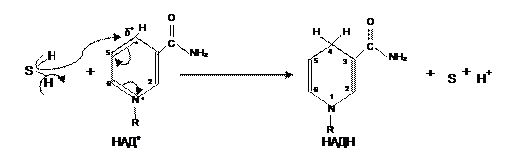
Рис. 7. Схема действия кофермента НАД+
Комплекс I катализирует суммарную реакцию восстановления убихинона (КоQ), сопряженную с трансмембранным переносом протонов (nН+) из матрикса митохондрий в межмембранное пространство:
 НАДН + Н+ + КоQ + nН+матр. НАД+ + КоQH2 + nН+межмемб.
НАДН + Н+ + КоQ + nН+матр. НАД+ + КоQH2 + nН+межмемб.
|

Далее электроны и протоны переходят к железосерным центрам Fe-S комплекса I, которые в конечном итоге и передают электроны на убихинон.
Если величина редокс–потенциала окисляемого субстрата выше – 0,32 вольт, тогда роль первичного акцептора выполняет комплекс II: сукцинат-убихинон-редуктаза, содержащая в качестве кофермента ФАД (флавинадениндинуклеотид), который синтезируется в клетке из ФМН путем переноса АМФ от молекулы АТФ. К таким энзимам принадлежат сукцинатдегидрогеназа (окисление янтарной кислоты в цикле Кребса), ацил-КоА-дегидрогеназа (подобное преобразование жирной кислоты в β-окислении), глицерол-1-фосфатдегидрогеназа (распад глицерина), в результате действия которых водород окисляемого субстрата, минуя НАД+, восстанавливает ФАД.

 Рис. 9. Схема действия ФМН (ФАД)
Рис. 9. Схема действия ФМН (ФАД)
Второй комплекс осуществляет перенос восстановительных эквивалентов от ФАДН2 (кофермент сукцинатдегидрогеназы) через Fe-S центры на убихинон, локализованный в липидном слое внутренней мембраны митохондрий (рис. 10).

Рис. 10. Схема превращения убихинона
Комплекс Ш: убихинон-цитохром–с-редуктаза, называемый также комплексом цитохромов bс1, осуществляет перенос электронов от восстановленного убихинона (КоQH2) на цитохром с. Это сопровождается трансмембранным –переносом протонов из митохондриального матрикса в межмембранное пространство.
Процесс передачи электронов от двухэлектронного переносчика убихинона к одноэлектронным – цитохромомам осуществляется в сложной цепи реакций, названных Q–циклом. В сильно упрощенном виде Q-цикл можно представить следующим образом (рис. 11).
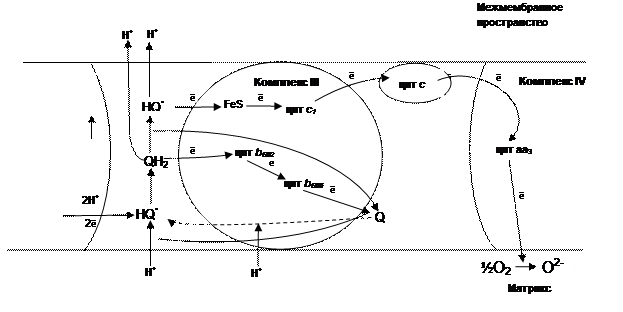
Рис. 10. Схема Q–цикла
Восстановленный в результате работы Комплексов I и II убихинон (КоQH2) диффундирует к наружной стороне внутренней мембраны, отдавая один электрон (через цитохром с1) на восстановление цитохрома с и освобождая в межмембранное пространство два протона. Образующееся при этом промежуточное соединение семихинон-радикал (КоQH•) передает второй электрон цитохрому b, который затем используется на восстановление других молекул КоQ (рис.11).
Несмотря на сложный путь движения электронов в комплексе III, окончательный результат прост: КоQH2 окисляется, а цитохром с - восстанавливается. При этом перенос одного электрона от КоQH2 к данному гемопротеину сопровождается выделением двух протонов (Н+) в пространство между мембранами, поэтому принято считать, что полное окисление одной молекулы КоQH2 протекает с восстановлением двух молекул цитохрома с и переносом четырех протонов из матрикса митохондрий в межмембранное пространство:
 КоQH2+2цит с (Fе3+) + 4Н+матр КоQ + 2цит с (Fe2+) + 4Н+межмемб.
КоQH2+2цит с (Fе3+) + 4Н+матр КоQ + 2цит с (Fe2+) + 4Н+межмемб.
Комплекс IV: цитохромоксидаза катализирует реакцию окисления восстановленного цитохрома с молекулярным кислородом, сопряженную с трансмембранным переносом протонов. Этот сложный олигомерный белок имеет в своем составе два гема (а и а3) и два иона Сu2+, обозначаемые как Сu2+А и Сu2+В. Электрон, полученный от цитохрома с, переносится на Сu2+А. Двигаясь в направлении от цитоплазматической поверхности вглубь мембраны, электрон перемещается от Сu2+А к гему а и далее к гему а3 и Сu2+B – последнему компоненту дыхательной цепи, восстанавливающему О2:
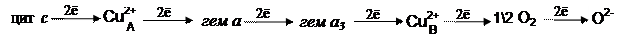
Таким образом, транспорт восстановительных эквивалентов от НАДН к кислороду сопровождается переносом катионов водорода из матрикса в межмембранное пространство (рис. 3), где создается трансмембранный градиент их концентрации: снаружи их в 10 раз больше, чем в матриксе. Возникающий градиент электрохимического потенциала ∆μН+ является движущей силой, стремящейся вернуть протоны обратно, чтобы устранить резкий перепад их величин. Однако возвратное движение ионов Н+ возможно только через специальные трансмембранные каналы (протонтранспортирующая двухсекторная АТФаза – F0-F1-АТФ-синтаза).