Составление уравнений окислительно-восстановительных реакций
A Электронный баланс - метод нахождения коэффициентов в уравнениях окислительно-восстановительных реакций, в котором рассматривается обмен электронами между атомами элементов, изменяющих свою степень окисления. Число электронов, отданное восстановителем равно числу электронов, получаемых окислителем.
Уравнение составляется в несколько стадий:
1. Записывают схему реакции.
KMnO4 + HCl ® KCl + MnCl2 + Cl2 + H2O
2. Проставляют степени окисления над знаками элементов, которые меняются.
KMn+7O4 + HCl-1 ® KCl + Mn+2Cl2 + Cl20 + H2O
3. Выделяют элементы, изменяющие степени окисления и определяют число электронов, приобретенных окислителем и отдаваемых восстановителем.
Mn+7 + 5ē ® Mn+2
2Cl-1 - 2ē ® Cl20
4. Уравнивают число приобретенных и отдаваемых электронов, устанавливая тем самым коэффициенты для соединений, в которых присутствуют элементы, изменяющие степень окисления.
| Mn+7 + 5ē ® Mn+2 | |
| 2Cl-1 - 2ē ® Cl20 |
––––––––––––––––––––––––
2Mn+7 + 10Cl-1 ® 2Mn+2 + 5Cl20
5. Подбирают коэффициенты для всех остальных участников реакции.
2KMn+7O4 + 16HCl-1 ® 2KCl + 2Mn+2Cl2 + 5Cl20 + 8H2O
B Электронно-ионный баланс (метод полуреакций) метод нахождения коэффициентов, в которомрассматривается обмен электронами между ионами в растворе с учетом характера среды:
| 2Cl1- – 2ē ® | Cl20 | ||
| MnO41- + 8H+ | + 5ē ® | Mn2+ + 4H2O | |
| 7+ | 2+ |
––––––––––––––––––––––––––––––––––––––
10Cl- + 2MnO41- + 16H+ ® 5Cl20 + 2Mn2+ + 8H2O
(для уравнивания ионной полуреакции используют H+, OH- или воду)
СУЩНОСТЬ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
Окислительно-восстановительные процессы принадлежат к числу более распространенных хим реакций и имеют большущее значение в теории и практике. Окисление-восстановление—один из важных действий природы.
Дыхание, усвоение углекислого газа растениями с выделением кислорода, обмен веществ и ряд остальных хим действий в базе собственной являются окислительно-восстановительными реакциями. Сжигание топлива в топках паровых котлов и движках внутреннего сгорания, электролитическое осаждение металлов, процессы, происходящие в гальванических элементах и аккумах, включают реакции окисления-восстановления.
Получение элементарных веществ (железа, хрома, марганца, золота, серебра, серы, хлора, йода и т.д.) и ценных хим товаров (аммиака, щёлочей, азотной, серной и остальных кислот) базирована на окислительно-восстановительных реакциях.
На окислении-восстановлении в аналитической химии основаны способы объёмного анализа: перманганатометрия, йодометрия, броматометрия, и остальные, играющие важную роль при контролировании производственных действий и выполнении научных исследований. В органической химии для проведения ряда хим перевоплощений самое обширное распространение отыскали процессы окисления-восстановления.
Инертные газы только в исключительных вариантах способны вступать в окислительно-восстановительные реакции.
54. Активные окислители
Чем больше абс. величина 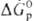 или
или 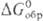 , тем более активным окислителем является данное в-во. Так, при обычных условиях в р-циях Са + Х2
, тем более активным окислителем является данное в-во. Так, при обычных условиях в р-циях Са + Х2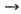 СаХ2 (где X = Cl, F), Са + 1/2O2,
СаХ2 (где X = Cl, F), Са + 1/2O2, 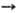 CaO хлор-более активный окислитель, чем О, но менее активный, чем F2 (
CaO хлор-более активный окислитель, чем О, но менее активный, чем F2 (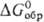 CaO -603,9, СаСl2 -749,3, CaF2 -1168,4 кДж/моль).
CaO -603,9, СаСl2 -749,3, CaF2 -1168,4 кДж/моль).
Активные восстановители
Чем больше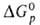 или абс. величина
или абс. величина , тем более активным восстановителем является данное в-во. так, при обычных условиях в р-циях nМ + mМ'Fn -> nMFm + mM'кальций - более активный восстановитель фторидов металлов (
, тем более активным восстановителем является данное в-во. так, при обычных условиях в р-циях nМ + mМ'Fn -> nMFm + mM'кальций - более активный восстановитель фторидов металлов (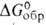 CaF2, отнесенная к одному атому фтора, - 584,2 кДж/моль), чем Mg (-535,5 кДж/моль) и А1 (-477,1 кДж/моль), но менее активный, чем Li (для LiF
CaF2, отнесенная к одному атому фтора, - 584,2 кДж/моль), чем Mg (-535,5 кДж/моль) и А1 (-477,1 кДж/моль), но менее активный, чем Li (для LiF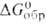 — 588,0 кДж/моль).
— 588,0 кДж/моль).
Влияние среды на характер протекания реакции: