рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Направление протекания окислительно-восстановительных реакций во многом определяется реакцией среды
Реферат Курсовая Конспект
Направление протекания окислительно-восстановительных реакций во многом определяется реакцией среды
Направление протекания окислительно-восстановительных реакций во многом определяется реакцией среды - раздел Химия, Гесса Закон, Основной Закон Термохимии, Согласно Которому Тепловой Эффект Реа...
Гесса закон, основной закон термохимии, согласно которому тепловой эффект реакции зависит лишь от начального и конечного состояний системы и не зависит от промежуточных состояний и путей перехода.
1)Химическая термодинамика раздел физической химии, рассматривающий термодинамические явления в области химии, а также зависимости термодинамических свойств веществ от их состава и агрегатного состояния. Т. х. тесно связана с термохимией, учением о равновесии химическом и учением о растворах (в частности, электролитов), теорией электродных потенциалов, с термодинамикой поверхностных явлений.
Т. х. базируется на общих положениях и выводах термодинамики и прежде всего - на первом начале термодинамики и втором начале термодинамики. Первое начало и важнейшее его следствие - Гесса закон служат основой термохимии. При термохимических расчётах большую роль играют теплоты образования веществ, значения которых для каждого из реагентов позволяют легко вычислить тепловой эффект реакции; для органических веществ подобную роль играют теплоты сгорания. Наряду с измерениями тепловых эффектов различных процессов (см. Калориметрия) используются и определение энергии связи между атомами на основе спектральных данных, и различные приближённые закономерности. Первое начало термодинамики лежит в основе Кирхгофа уравнения, выражающего температурную зависимость теплового эффекта химической реакции.
Калориметрия (от лат. calor — тепло и лат. metro — измеряю) — совокупность методов измерения количества теплоты, выделяющейся или поглощаемой при протекании различных физических или химических процессов
Свободная энергия Гиббса (или просто энергия Гиббса, или потенциал Гиббса, или термодинамический потенциал в узком смысле) — это термодинамический потенциал следующего вида:

Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т. д.)
Самопроизвольное протекание изобарно-изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшением энтальпии системы (ΔH), и энтропийным T ΔS, обусловленным увеличением беспорядка в системе вследствие роста ее энтропии. Разность этих термодинамических факторов является функцией состояния системы, называемой изобарно-изотермическим потенциалом или свободной энергией Гиббса (G, кДж):
Классическим определением энергии Гиббса является выражение

где U — внутренняя энергия, P — давление, V — объем, T — абсолютная температура, S — энтропия.
Направление протекания окислительно-восстановительных реакций во многом определяется реакцией среды
2Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причем скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем
если на систему, находящуюся в равновесии, воздействовать извне, изменяя какое-нибудь из условий (температура, давление, концентрация), то равновесие смещается таким образом, чтобы компенсировать изменение.
Конста́нта равнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями, концентрациями или фугитивностями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции.
3)Химическая кинетика или кинетика химических реакций — раздел физической химии, изучающий закономерности протекания химических реакций во времени, зависимости этих закономерностей от внешних условий, а также механизмы химических превращений.[
Вант-Гоффа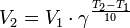
 — скорость реакции при температуре
— скорость реакции при температуре  ,
,  — скорость реакции при температуре
— скорость реакции при температуре  ,
, 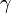 — температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов).
— температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов).
4) Скорость химической реакции зависит от природы реагирующих веществ и условий протекания реакции: концентрации с, температуры t , присутствия катализаторов, а также от некоторых других факторов (например, от давления - для газовых реакций, от измельчения - для твердых веществ, от радиоактивного облучения).
Влияние концентраций реагирующих веществ. Чтобы осуществлялось химическое взаимодействие веществ А и В, их молекулы (частицы) должны столкнуться. Чем больше столкновений, тем быстрее протекает реакция. Число же столкновений тем больше, чем выше концентрация реагирующих веществ. Отсюда на основе обширного экспериментального материала сформулирован основной закон химической кинетики, устанавливающий зависимость скорости реакции от концентрации реагирующих веществ:
5) Состояние химического равновесия сохраняется только до тех пор, пока остаются не измененными условия равновесия, т.е. концентрации реагирующих веществ и температура, а для реакций с участием газов – давление. Всякое изменение указанных условий приводит к нарушению равновесия. В системе ликвидируется равенство скоростей прямой и обратной реакций и начинает преобладать одна из них. Так продолжается до тех пор, пока снова не наступит равенство скоростей прямой и обратной реакций и опять не установится состояние равновесия, отвечающее новым условиям. Переход системы из одного состояния равновесия в другое называется смещением химического равновесия.
Правило смещения химического равновесия под влиянием изменения внешних условий было сформулировано Ле Шателье.
Если на систему, находящуюся в равновесии, производится какое- либо воздействие, то в системе возникают процессы, идущие в направлении, препятствующем этому воздействию.
Т.е если изменить одно из условий, при которых система находится в состоянии химического равновесия, например концентрацию, температуру или давление, то равновесие смещается в сторону той реакции, которая противодействует произведенному изменению.
Увеличение концентрации одного из участвующих в реакции веществ вызывает в системе процесс, ведущий к уменьшению концентрации этого вещества. Так, например, если в равновесную систему N2 + 3H2 - 2NH3 ввести дополнительное количество водорода, то такое воздействие приведет к ускорению реакции взаимодействия водорода с азотом.
Большое значение при промышленном использовании обратимых химических реакций имеют катализаторы. Однако катализаторы никогда не смещают равновесия. Они уменьшают время, необходимое для достижения равновесия. Во сколько раз катализаторы ускоряют прямую реакцию, во столько же – и обратную.
Во всех обратимых реакциях скорость прямой реакции уменьшается, скорость обратной реакции возрастает до тех пор, пока обе скорости не станут равными и не установится состояние равновесия. (ле-шателье)
6При соприкосновении проводника первого рода (электрода) с полярным растворителем (водой) либо раствором электролита на границе электрод – жидкость возникает т.н. двойной электрический слой)
Электродный потенциал, разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита). Возникновение Э. п. обусловливается переносом заряженных частиц через границу раздела фаз, специфической адсорбцией ионов, а при наличии полярных молекул (в том числе молекул растворителя) — ориентационной адсорбцией их. Величина Э. п. в неравновесном состоянии зависит как от природы и состава контактирующих фаз, так и от кинетических закономерностей электродных реакций на границе раздела фаз. Равновесное значение скачка потенциалов на границе раздела электрод/раствор определяется исключительно особенностями электродной реакции и не зависит от природы электрода и адсорбции на нём поверхностно-активных веществ. Эту абсолютную разность потенциалов между точками, находящимися в двух разных фазах, нельзя измерить экспериментально или рассчитать теоретически. Практическое значение имеют относительные Э. п., обычно называемые просто Э. п., представляющие собой разность Э. п. рассматриваемого электрода и электрода сравнения — чаще всего нормального водородного электрода, Э. п. которого условно принимается равным нулю.
7)Гальвани́ческий элеме́нт — химический источник электрического тока, Принцип действия гальванического элемента основан на взаимодействии двух металлов через электролит, приводящем к возникновению в замкнутой цепи электрического тока. ЭДС гальванического элемента зависит от материала электродов и состава электролита.(гальв элементы угольно-цинковые. Щелочные)
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ - химический источник тока, в котором электрическая энергия вырабатывается в результате прямого преобразования химической энергии окислительно-восстановительной реакцией. В состав гальванического элемента входят два разнородных электрода (один - содержащий окислитель, другой - восстановитель), контактирующие с электролитом. Различают гальванические элементы одноразового использования (т. н. первичные элементы, напр. Лекланше элемент), многоразового действия (электрические аккумуляторы) и с непрерывной подачей реагентов (топливные элементы). Ранее термин "гальванический элемент" относился только к первичным элементам.
8) ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЙ ПОТЕНЦИАЛ, равновесная разность гальвани-потенциалов (см. Межфазные скачки потенциала)между электролитом (р-ром, расплавом, твердым электролитом) и металлом (или др. электронным проводником), при к-рой с равной скоростью протекают р-ции окисления и восстановления.
Простейший пример возникновения окислительно-восстановительного потенциала представляет система, в к-рой устанавливается равновесие между атомами металла и соответствующими катионами р-ра, напр.: Zn Zn2+ + 2е, Сu
Zn2+ + 2е, Сu Cu2+ + 2е и т.п. В таких системах окислительно-восстановительный потенциал зависит от природы металла и термодинамич. активности окисленной формы (Zn2+, Cu2+).
Cu2+ + 2е и т.п. В таких системах окислительно-восстановительный потенциал зависит от природы металла и термодинамич. активности окисленной формы (Zn2+, Cu2+).
Если индифферентный электрод погружен в электролит, содержащий окислит.-восстановит. (редокс-) систему, то в такой системе протекает два электродных процесса, или две окислит.-восстановит. полуреакции, сопровождающиеся переходом электронов между участвующими в р-ции молекулами или (и) ионами. В общем виде этот процесс м.б. изображен: Ох + ne Red (Ox и Red - окисленная и восстановленная формы частицы или частиц, п - число электронов, участвующих в р-ции). Окислительно-восстановительный потенциал, возникающий в таких системах, зависит от природы редокс-реакции и от активностей (фугитивностей) обоих электроактивных соед., а также др. возможных участников процесса (напр., Н+, ОН- и т.д.) и не зависит от материала электрода.
Red (Ox и Red - окисленная и восстановленная формы частицы или частиц, п - число электронов, участвующих в р-ции). Окислительно-восстановительный потенциал, возникающий в таких системах, зависит от природы редокс-реакции и от активностей (фугитивностей) обоих электроактивных соед., а также др. возможных участников процесса (напр., Н+, ОН- и т.д.) и не зависит от материала электрода.
10) РЯД НАПРЯЖЕНИЙ (электрохимический ряд), перечень, в который включены металлы и один газ - водород, указывающий на относительную способность этих веществ к окислению (т.е. к потере электронов при химических реакциях - см. ОКИСЛЕНИЕ-ВОССТАНОВЛЕНИЕ). Ряд начинается с металла, у которого тенденция к потере электронов выражена наиболее явно. Окислительный потенциал стандартного водородного электрода произвольно принят равным нулю, и с ним сравнивают все металлы. Те из них, у которых способность терять электроны выше, чем у водорода, называются электро-отрицательными, а если эта способность у них ниже, - электроположительными (в США принято давать обратный знак). Наиболее распространенные металлы в электрохимическом ряду располагаются в таком порядке: литий, калий, кальций, натрий, магний, алюминий, цинк, хром, железо, кобальт, никель, олово, свинец, водород, медь, ртуть, серебро, платина и золото.
Ряд напряжений (реже — ряд активностей), последовательность расположения металлов и их ионов в порядке возрастания стандартных электродных потенциалов в растворах электролитов. Электродом сравнения обычно служит стандартный водородный электрод. Поэтому в Ряд напряжений включают и водород, электродный потенциал которого принимается равным нулю. В СССР и многих других европейских странах электродному потенциалу принято давать знак, одинаковый со знаком заряда электрода из данного металла по отношению к стандартному водородному электроду (в США принято давать обратный знак). Наибольшие отрицательные потенциалы характерны для щелочных металлов (около — 3 в), за ними следуют щёлочноземельные металлы и т. д.; наиболее положительные потенциалы имеют благородные металлы (около + 1,5 в; численные значения см. в ст. Металлы, табл. 2 и 3). В Ряд напряжений часто включают неметаллы, ионы и некоторые химические соединения. Наиболее распространённые металлы расположены в Ряд напряжений в следующей последовательности: Li, К, Ca, Na, Mg, Al, Mn, Zn, Fe, Co, Ni, Sn, Pb, H2, Cu, Hg,
Водородныйэлектрод, платиновая пластинка, электролитически покрытая платиновой чернью, погружённая в раствор кислоты с определённой концентрацией ионов водорода Н+ и омываемая током газообразного водорода. Потенциал Водородныйэлектрод возникает за счёт обратимо протекающей реакции
Водоро́дный электро́д — электрод, использующийся в качестве электрода сравнения при различных электрохимических измерениях и в гальванических элементах. Водородный электрод (ВЭ) представляет собой пластинку или проволоку из металла, хорошо поглощающего газообразный водород (обычно используют платину или палладий), насыщенную водородом (при атмосферном давлении) и погруженную в водный раствор, содержащий ионы водорода. Потенциал пластины зависит[уточнить] от концентрации ионов Н+ в растворе. Электрод является эталоном, относительно которого ведется отсчет электродного потенциала определяемой химической реакции. При давлении водорода 1 атм., концентрации протонов в растворе 1 моль/л и температуре 298 К потенциал ВЭ принимают равным 0 В. При сборке гальванического элемента из ВЭ и определяемого электрода, на поверхности платины обратимо протекает реакция:
2Н+ + 2e− = H2
11)Электролиз - это окислительно-восстановительный процесс, который происходит на электродах во время прохождения электрического тока через расплав или раствор.
Электролиз - это ещё один способ получения чистых металлов и неметаллов. Кроме того, электролиз можно провести и в домашних условиях. Нужен источник тока, два электрода (какие электроды бывают и какой в каком случае брать - расссказано дальше) и, конечно, электролит. Электролит - это раствор, который проводит электрический ток.
Различают электролиз растворов и расплавов. Оба эти процесса электролиза существенно отливчаются друг от друга. Отличие - в наличии растворителя. При электрролизе растворов кроме ионов самого вещества в процессе учавствуют ионы растворителя. При электролизе расплавов - только ионы самого вещества.
Для того, чтобы получить нужный продукт (газ, металл или неметалл), нужно правильно выбрать электрод и раствор электролита.
Электродами могут служить любые материалы, проводящие электрический ток. В основном применяют металлы и сплавы, из неметаллов электродами могут служить, например, графитовые стержни (или углерод). Реже в качестве электрода используют жидкости.
Электрод, заряженный положительно - анод. Электрод, заряженный отрицательно - катод. При электролизе происходт окисление анода (он растворяется) и восстановление катода. Именно поэтому анод следует брать таким, чтобы его растворение не повлияло на химический процесс, протекающий в растворе или расплаве. Такой анод называют инертным электродом. В качестве инертного анода можно взять графит (углерод) или платину.
В качестве катода можно взять металлическую пластину (она не будет растворяться). Подойдёт медь, латунь, углерод (или графит), цинк, железо, алюминий, нержавейка.
12) ПОЛЯРИЗАЦИЯ ЭЛЕКТРОДНАЯ
разность между значениями электродных потенциалов при равновесии и при пропускании через электрод внеш. электрич. тока. Различают концентрационную (вызванную разницей концентраций реагирующих в-в вблизи электрода и в объёме р-ра электролита) и электрохим. (обусловленную конечной скоростью процессов на границе электрод - р-р электролита) П. э.
Типы поляризации
Электролиз расплава хлорида натрия: NaCl Na+ + Cl–; катод (–) (Na+): Na+ + е = Na0,Электрохимические эквиваленты разных веществ относятся как их химические эквиваленты. Химический эквивалент иона – это отношение молярной массы вещества иона к его валентности.
Выражается это следующей формулой:

где
А – это молярная масса иона;
z – это валентность иона;
F – это постоянная Фарадея.
19) Электрохимическим рафинированием получают очень чистые металлы. [2]
Процессы электрохимического рафинирования олова, а также и осаждения его из растворов осуществляются с применением как простых солей, так и комплексных соединений. [3]
При электрохимическом рафинировании меди применяют электролит, содержащий в 1 л 30 - 45 г меди в виде сульфата и около 200 г свободной серной кислоты. [4]
При электрохимическом рафинировании металлов или в некоторых гальванических процессах происходит растворение анода, при этом восполняется расход ионов металла на катодное осаждение. [5]
20) Электрохимическая обработка металлов, группа методов, предназначенных для придания обрабатываемой металлической детали определенной формы, заданных размеров или свойств поверхностного слоя. Осуществляется в электролизерах (электролитических ваннах, электрохимических ячейках специальных станков, установок), где обрабатываемая деталь является либо анодом (анодная обработка), либо катодом (катодная обработка), либо тем и другим попеременно. Основной вид катодной электрохимической обработки металлов - гальваностегия.
ЭЛЕКТРОХИМИЧЕСКАЯ ОБРАБОТКА
совокупность методов обработки, осн. на законах электрохимии. По используемым электродным процессам различают анодную и катодную, по технологич. возможностям - размерную и поверхностную.
ГАЛЬВАНОТЕХНИКА
ГАЛЬВАНОТЕХНИКА (от гальвано... и техника) - область прикладной электрохимии, охватывающая…ЭЛЕКТРОЛИЗ
ЭЛЕКТРОЛИЗ (от электро... и греч. lysis - разложение, растворение, распад) - хим.… 21)Двухпо́люсник — многополюсник, имеющий две точки подключения.Строение молекул
Молекулы, которые образованы атомами одного и того же элемента, как правило, будут неполярными, как неполярны и сами связи в них. Так, молекулы Н2,… Молекулы, которые образованы атомами разных элементов, могут быть полярными и… олярность молекулы определяется разностью электроотрицательностей атомов, образующих двухцентровую связь, геометрией…Sp-гибридизация
Одна s- и три р-орбитали смешиваются, и образуются четыре равноценные по форме и энергии sp3-гибридные орбитали Только хлорид бериллия ВеCl2. Два атома хлора оттягивают электроны от атома… В метане углерод находится в состоянии sp3-гибридизации, и соответственно угол между этими орбиталями 109 с небольшим…– Конец работы –
Используемые теги: направление, протекания, окислительно-восстановительных, реакций, многом, определяется, реакцией, среды0.112
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Направление протекания окислительно-восстановительных реакций во многом определяется реакцией среды
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов