рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Таким образом, курс Общая химия является базовым для последующего изучения общепрофессиональных и специальных дисциплин
Реферат Курсовая Конспект
Таким образом, курс Общая химия является базовым для последующего изучения общепрофессиональных и специальных дисциплин
Таким образом, курс Общая химия является базовым для последующего изучения общепрофессиональных и специальных дисциплин - раздел Химия, ...

((
ВВЕДЕНИЕ
Химия – одна из фундаментальных наук естествознания, формирующих естественно-научное мировоззрение будущих специалистов. Наличие прочных химических знаний способствует воспитанию творческой личности, целостно воспринимающей мир, способной прогнозировать эффективность новых решений, организовывать их практическую реализацию, активно влиять на процессы, происходящие в социальной и профессиональной сферах.
Таким образом, курс «Общая химия» является базовым для последующего изучения общепрофессиональных и специальных дисциплин.
Лабораторный практикум является одной из важных частей курса общей химии. Аналитические задания вместе с гальванотехническими экспериментами, электролизом, исследованием коррозии способствуют укреплению связи химии с различными инженерными специальностями.
ОБЩИЕ ПРАВИЛА РАБОТЫ В ЛАБОРАТОРИИ
Каждый студент, работающий в химической лаборатории, должен строго соблюдать следующие правила работы: 1. Перед каждой лабораторной работой изучить относящийся к ней теоретический… 2. Проводить опыты только после внимательного прочтения полного описания работы и уяснения техники её выполнения.СТРУКТУРА ОТЧЁТА
О лабораторных работах
Запись выполненных работ и отдельных опытов производится согласно СТП-02 - 99 нa листах бумаги формата А4 размером 210х287. Отчёт о лабораторной работе должен включать в указанной ниже… - цель работы и основные задачи;Лабораторная работа №1
ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ МАССЫ ЭКВИВАЛЕНТА (ЭКВИВАЛЕНТНОЙ МАССЫ) МЕТАЛЛА ПО ОБЪЕМУ ВЫТЕСНЕННОГО ВОДОРОДА
Ц е л ь р а б о т ы: ознакомиться с методикой определения и расчёта молярной массы эквивалента металлов.
О б о р у д о в а н и е и м а т е р и а л ы: штатив, две бюретки на 50 см3, пробирка с газоотводной трубкой, термометр, барометр, аналитические весы и разновесы; навеска металла около 0,01 г; 2,5 М раствор НС1.
Методика выполнения работы
Прибор для определения молярной массы эквивалента металлов изображён на рис. 1.1. и состоит из: двух бюреток 1 на 50 см3, соединённых резиновой трубкой, реакционной пробирки… Перед началом работы испытывают прибор на герметичность. Для этого соединяют верхний конец правой бюретки с пробиркой,…Таблица 1.1
Давление насыщенного водяного пара в равновесии с водой
Контрольные вопросы
1. Что называется молярной массой эквивалента элемента? В каких единицах измеряется молярная масса эквивалента?
2. Дайте определение молярного объёма эквивалента газа. В каких единицах выражается эта величина?
3. Сформулируйте закон эквивалентов. Выразите его математически.
4. Следствием каких более общих законов является закон эквивалентов?
5. С какой целью объём выделившегося водорода приводится к нормальным условиям?
6. Какие факторы оказывают влияние на точность определения молярной массы эквивалента металла при взаимодействии его с кислотой?
7. В каких случаях реакция вытеснения водорода из кислот неприменима для определения молярной массы эквивалента металла?
Лабораторная работа №2
ЗАВИСИМОСТЬ СВОЙСТВ ЭЛЕМЕНТОВ ОТ ИХ ПОЛОЖЕНИЯ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ Д.И. МЕНДЕЛЕЕВА
Ц е л ь р а б о т ы: изуч ить на практике, как изменяются свойства элементов и их соединений по мере увеличения заряда их ядра на примере элементов… О б о р у д о в а н и е и м а т е р и а л ы: аппарат Киппа, спиртовая горелка,…Методика выполнения работы
Налить в фарфоровую чашку немного воды, опустить в неё кусочек натрия и быстро прикрыть чашку часовым стеклом или воронкой. (Осторожно! Брызги… Опыт №2. Действие воды на металлический магний Поместить в пробирку стружку металлического магния, добавить немного воды и 2–3 капли раствора фенолфталеина. Обратить…Контрольные вопросы
1. Что такое энергия ионизации и сродство к электрону, и как эти величины изменяются в периодах и группах периодической системы Д.И. Менделеева?
2. Чем объяснить наличие металлических свойств у одних элементов и неметаллических – других?
3. Какие элементы называются амфотерными, почему?
4. Почему происходит взаимодействие серы с цинком?
5. Как изменяются свойства оксидов одного и того же элемента с увеличением его степени окисления в оксидах?
6. У какого элемента, Са или Fe, металлические свойства выражены сильнее?
7. У какого элемента, Вr или I, неметаллические свойства выражены сильнее?
8. Приведите современную формулировку периодического закона.
Лабораторная работа №3
ОПРЕДЕЛЕНИЕ ТЕПЛОВЫХ ЭФФЕКТОВ ХИМИЧЕСКИХ ПРОЦЕССОВ
О б о р у д о в а н и е и м а т е р и а л ы: калориметр со взвешенным стаканом, термометр с ценой деления 0,1є, технохимические весы с разновесами,… Методика выполнения работыТаблица 3.1
Результаты измерений
Расчеттеплового эффекта:Таблица 3.2
Результаты измерений
Расчеттеплового эффекта: 1.Рассчитать, сколько теплоты (ДН, Дж) выделяется при нейтрализации 50 см3 0,5М раствора HCl:Контрольные вопросы
1. Что называется стандартной энтальпией образования соединения? Какие условия принято называть стандартными?
2. Какие химические реакции называются экзотермическими, эндотермическими?
3. Почему энтальпия нейтрализации сильной кислоты сильным основанием одинакова для различных кислот и оснований?
4. Чему равна энтропия идеального кристалла при абсолютном нуле? В каких единицах изменяется энтропия?
5. Какую информацию о веществе можно получить, используя значения энергии Гиббса?
6. Какими одновременно действующими факторами определяется направленность химического процесса?
7. Стандартные энтальпии образования ДН0298(кДж/моль) НН3 и РН3 равны соответственно – 46,2 и + 5,4. Какой следует сделать вывод из этих данных об относительной устойчивости молекул НН3 и РН3?
Лабораторная работа №4
ПРИГОТОВЛЕНИЕ РАСТВОРОВ
Ц е л ь р а б о т ы: ознакомиться со способами выражения концентрации растворов; овладеть методикой расчётов концентраций растворов и приготовления… О б о р у д о в а н и е и м а т е р и а л ы: аналитические весы с разновесами,…Методика выполнения работы
Получить у преподавателя задание на приготовление раствора соляной кислоты определённой массовой доли из исходного раствора кислоты. Для расчета объема исходной кислоты необходимо знать ее массовую долю и… Далее, пользуясь данными табл. 4.1, определить массовую долю растворенного вещества в растворе исходной соляной…Таблица 4.1
Соотношения массовых долей и плотностей раствора HCl (20єС)
| Массовая доля HCl W, % | Плотность раствора HCl, с, г/см3 |
| 4,0 | 1,019 |
| 8,0 | 1,039 |
| 12,0 | 1,059 |
| 16,0 | 1,079 |
| 20,0 | 1,100 |
| 24,0 | 1,121 |
| 28,0 | 1,142 |
Если в таблице нет замеренных значений плотности, то массовую долю необходимо вычислить методом линейной интерполяции. Пусть замеренная плотность раствора HCl равна 1,089. По табл. 4.1 выбрать значения плотности меньше и больше замеренного и соответствующие им массовые доли.
Найти разность в значениях массовой доли и плотности:
20,0% ---------1,100 г/см3
16,0%--------- -1,079 г/см3
20,0-16,0=4%--------1,100-1,079=0,021 г/см3
Затем из большего значения плотности вычесть замеренное значение (1,089 г/см3): 1,100-1,089 = 0,011 г/см3.
Составить соотношение:
4%-----0,021 г/см3
Х%-----0,011 г/см3
 .
.
Полученное значение (2,1%) отнять от 20%:
Wисх(HCl ) = 20,0-2,1=17,9%.
Это и будет массовая доля соляной кислоты, позволяющая рассчитать объем исходного раствора, необходимого для приготовления HCl заданной концентрации.
Далее рассчитать объем исходной кислоты и приготовить раствор. С помощью пипетки отмерить рассчитанный объем исходной кислоты HCl, перенести в мерную колбу и довести воду до заданного объема.
Опыт №2.Определение концентрации приготовленного раствора соляной кислоты методом кислотно-основного титрования
В три конические колбочки налить при помощи мерной пипетки по 1 см3
приготовленной соляной кислоты и добавить в каждую по 2–3 капли фенолфталеина. Поставить колбочку на лист белой бумаги. Постоянно перемешивая жидкость, приливать в нее из пипетки небольшими порциями раствор щелочи известной концентрации до появления слабо-розовой окраски раствора. В кислом растворе фенолфталеин бесцветен, а в слабощелочном растворе приобретает малиновую окраску. Появление окраски свидетельствует о полной нейтрализации кислоты щелочью.
Повторить титрование три раза и сделать расчет концентрации приготовленного раствора HCl (Соп). Определить относительную ошибку опыта, сравнивая Соп с заданной концентрацией Сm.
Результаты свести в табл. 4.2.
Таблица 4.2
Результаты расчетов
Опыт №3. Приготовление раствора заданной концентрации из навески твердого вещества и воды Получить у преподавателя задание на приготовление раствора соли определённой… Рассчитать массу воды, необходимой для приготовления заданного раствора с учётом кристаллизационной воды в навеске. С…Таблица 4.3
Плотность водного раствора сульфата никеля при температуре 18 °С
Раствор слить в специальную ёмкость (в раковину не выливать!). Произвести… Результаты расчётов свести в табл. 4.4.Таблица 4.4
Результаты расчетов
Сделать выводы.Контрольные вопросы
1. Что называется концентрацией?
2. Что такое титр, в каких единицах он выражается?
3. Напишите формулу, связывающую титр с молярной концентрацией эквивалента?
4. Дайте определение молярной концентрации; в каких единицах она выражается?
5. Какие виды концентрации изменяют свои численные величины с изменением температуры, а какие – не изменяют?
6. Дайте определение молярной концентрации эквивалента. В каких единицах она выражается?
7. Что называется моляльностью? В каких единицах выражается моляльность раствора?
8. Приведите определение мольно-долевой концентрации. Какие значения она может принимать?
9. Какой объём соляной кислоты, содержащей 0,35 массовых долей НС1, необходимо взять для приготовления 2 дм3 раствора с молярной концентрацией, равной 0,2 моль/дм ?
Лабораторная работа №5
ОПРЕДЕЛЕНИЕ МОЛЕКУЛЯРНОЙ МАССЫ ВЕЩЕСТВА КРИОСКОПИЧЕСКИМ МЕТОДОМ
Ц е л ь р а б о т ы: ознакомиться с методом экспериментального определения и расчета молекулярной массы неэлектролитов.
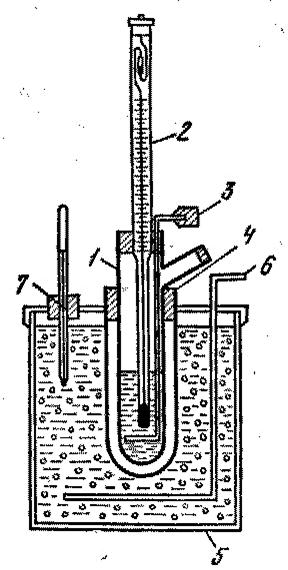 О б о р у д о в а н и е и м а т е р и а л ы: водный раствор неэлектролита известного молекулярного состава с известной процентной концентрацией, прибор для криоскопических измерений
О б о р у д о в а н и е и м а т е р и а л ы: водный раствор неэлектролита известного молекулярного состава с известной процентной концентрацией, прибор для криоскопических измерений
Методика выполнения работы
Он состоит из стеклянной пробирки 1, закрытой пробкой, в которую вставлен дифференциальный термометр Бекмана 2 и металлическая мешалка 3 (рис.5.1).… В толстостенный стакан со снегом или кусочками льда добавляют поваренную соль… По термометру следят, чтобы температура смеси держалась около -6°C. В пробирку 1 наливают такое количество…Таблица 5.1
Результаты опыта
Контрольные вопросы
1. Для каких растворов точно выполняются законы Рауля и Вант-Гоффа ?
2. Что такое эбуллиоскопическая и криоскопическая константы, в каких единицах они выражаются?
3. Какие свойства разбавленных растворов не зависят от природы растворенного вещества?
4. Сколько г глюкозы нужно растворить в 270 г воды для понижения температуры застывания на 1°?
5. При растворении 1,5 г фенола С6Н5ОН в 10 г этанола температура кипения повысилась на 0,185°. Определите эбуллиоскопическую константу спирта.
6. Осмотическое давление плазмы крови человека при температуре 37°С равно 7,7 атм. Какое количество сахарозы необходимо взять для приготовления 0,5 л раствора, изотоничного крови?
Лабораторная работа №6
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ И ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Ц е л ь р а б о т ы: ознакомиться с понятием скорости химических реакций; факторами, влияющими на её величину, а также влиянием изменения внешних… О б о р у д о в а н и е и м а т е р и а л ы: растворы KIOз, Na2SOз, H2S04,…Методика выполнения работы
Зависимость скорости реакции от концентрации в гомогенной системе изучим на примере реакции 2KIOз+5Na2SOз+H2S04=K2S0 4+5Na2S0 4+I 2+H 2О. При взаимодействии йода калия с сульфатом натрия в кислой среде образуется элементарный йод, который можно обнаружить…Таблица 6.1.
Результаты опыта
Приняв концентрацию раствора йодата калия, к которому не добавляли воду, за единицу, вычислить концентрации в двух других случаях. Построить график… v=1/ t, c-1С, моль/л
Опыт № 2. Зависимость скорости реакции от температуры Зависимость скорости реакции от температуры в гомогенной среде изучают на примере реакцииТаблица 6.2
Результаты опыта
Рис.6.2 Сделать вывод о зависимости скорости реакции от температуры. Из графика определяют тангенс угла наклона β и…Таблица 6.3
Катализатор …… Температура опыта…….. Объем Н2О2..................
| Время измерения по секундомеру | Время от начала реакции, мин | Уровень жидкости в бюретке, см3 | Объем выделившегося газа, см3 | Скорость реакции | lg(б∞–бф) | lgхф | Константа скорости ki | kср |
Из температурной зависимости константы скорости рассчитать энергию активации Еа по уравнению
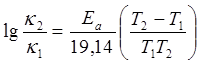 .
.
Опыт № 4. Скорость реакции в гетерогенной системе
Налить в две пробирки по 5 см3 2,5 М соляной кислоты. Отвесить на технохимических весах две навески по 0,2 г мрамора в кусочках, одну навеску мрамора растереть в ступке в порошок. Затем одновременно в одну пробирку ссыпать порошок, а в другую – бросить кусочки мрамора. Заметить время, которое потребовалось для полного растворения мрамора. Для обоих случаев подсчитать относительную скорость реакции (н=1/т). Определить, в каком случае скорость реакции больше и во сколько раз? Результаты опыта свести в табл. 6.4
Таблица 6.4
Результаты опыта
В три пробирки налить по 2 см3 0,1 М Nа2S2O3 и добавить по 1; 2; 3 см3 0,05 М CuS04. Кроме того, в первые две пробирки добавить 2 и 1 см3 воды,…Таблица 6.5
Результаты опыта
Построить график зависимости скорости реакции от концентрации катализатора… Опыт №6. Влияние концентрации реагирующих веществ на смещение химического равновесияКонтрольные вопросы
1. Дайте определение скорости химической реакции, в каких единицах выражается её величина?
2. Каков физический смысл константы скорости химической реакции?
3. Какова зависимость между скоростью химической реакции и температурой?
4. Какие реакции называются обратимыми и необратимыми?
5. Сформулируйте закон действия масс.
6. Что называется химическим равновесием?
7. Какие факторы влияют на смещение химического равновесия?
Лабораторная работа №7
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ СРЕДЫ. ГИДРОЛИЗ СОЛЕЙ
Ц ел ь р а б о т ы: изучить условия протекания процесса гидролиза солей и влияние факторов, обусловливающих смещение ионного равновесия при гидролизе.
О б о р у д о в а н и е и м а т е р и а л ы: иономер И-130, штатив с пробирками, растворы солей, кислот, щелочей, индикаторы, кристаллы солей, спиртовая горелка, пипетка, универсальная индикаторная бумага.
Методика выполнения
В разные пробирки внести небольшое количество следующих соединений: НС1; NaOH; NaCI; Nа2СО3; ZnCl2; Сu(СН3СОО)2. Во все пробирки прилить одинаковое… Составить молекулярные и ионные уравнения гидролиза солей. Дать объяснение… Таблица 7.1Результаты опыта
Опыт №2. Усиление гидролиза одной соли раствором другой гидролизующейся соли К 3 cм3 концентрированного раствора FеС1з (соль образована слабым основанием и… Опыт №3. Растворение металлов в продуктах гидролиза солейКонтрольные вопросы
1. Какие соли подвергаются гидролизу?
2. К чему сводится суть реакций гидролиза?
3. Какие факторы влияют на степень гидролиза солей?
4. Чем объяснить растворение металлов в растворах некоторых солей?
5. Как можно усилить или подавить гидролиз?
6. Почему при разбавлении раствора гидролизующейся соли происходит увеличение степени гидролиза её?
7. Почему при приготовлении раствора хлорида цинка его подкисляют соляной кислотой?
8. Может ли существовать водный раствор ацетата железа?
Лабораторная работа №8
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ
О б о р у д о в а н и е и м а т е р и а л ы: штатив с пробирками, растворы С6Н12О6, СН3СООН(0,1н), СН3СООН(конц.), NаОН, NН4ОН, НС1(1:3), Na2SO4,…Методика выполнения работы
Налить в 8 химических стаканов водные растворы следующих веществ: С6Н12О6 , Н2О(дист), СН3СООН(0,1н), СН3СООН(конц.), NаОН, NН4ОН, НС1(1:3), Na2SO4,… Опыт №2.Условия образования осадковКонтрольные вопросы
1. Что такое произведение растворимости?
2. Каково условие выпадения осадка малорастворимого вещества из раствора?
3. Какие факторы влияют на растворимость осадка?
4. Вычислите произведение растворимости СаСО3, если концентрация насыщенного раствора СаСО3 при температуре 18°С равна 1,3·10-4 моль/дм3.
5. ПР(ВаSO4) = 1,1 ·10-10. Какой объем воды необходим для растворения при температуре 25°С 1 г ВаSO4?
6. Не произведя вычислений, расположите вещества в порядке увеличения их растворимости, используя значения ПР:
AgCl, AgBr, AgI. [ПР(AgCl) =1,78·10-10; ПР(AgBr) =5,3·10-13;
ПР(AgI) =8,3·10-17
7. В 500 см3 воды при температуре 18°С растворяется 0,0166 г Ag2CrO4. Чему равно произведение растворимости этой соли?
8. В каком из указанных случаев раствор электролита МХ ненасыщен и почему:
а) [М2+]·[Х2-]<ПР; б) [М2+]·[Х2-]=ПР; в) [М2+]·[Х2-]>ПР?
Лабораторная работа № 9
ПОЛУЧЕНИЕ И ИЗУЧЕНИЕ СВОЙСТВ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
О б о р у д о в а н и е и м а т е р и а л ы: штатив с пробирками, растворы H2S04, NaOH, NН4OH, NH4Fe(SO4)2, К3[Fe(CN)6], CrС13, ВаСl2, ZnСl2, H2O2,…Методика выполнения работы
Взять пять пробирок. В три из них поместить по 2–3 см3 раствора аммониево-железных квасцов NH4Fe(SO4)2, а в две – по 2–3 см3 раствора… Затем в первую пробирку прибавить несколько капель раствора роданида… При записи результатов опыта показать, на какие ионы диссоциируют в водном растворе аммониево-железные квасцы? На…Контрольные вопросы
1. Каково строение комплексного соединения?
2. В чем заключается особенность диссоциации комплексных соединений?
3. Что такое константа нестойкости комплексного иона ?
4. Напишите формулы следующих комплексных соединений: гексанитрокобальтат (III) натрия; гексамминникель (III) хлорид; пентакарбонилжелезо (0).
5. Составьте формулу комплексного соединения из ионов K+, Cu+, Cl- , координационное число которого равно 2. Определите молекулярную массу комплексного иона.
6. В каком из указанных соединений есть Pt2+:
1) Cr [PtCl6];
2) K2 [PtCl4];
3) [PtCl(NH3)5]Cl3?
Лабораторная работа № 10
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Ц е л ь р а б о т ы: ознакомиться с сущностью и классификацией окислительно-восстановительных реакций, получить практические навыки составления… О б о р у д о в а н и е и м а т е р и а л ы: штатив с пробирками, фарфоровая…Методика выполнения
Окислители и восстановители, окислительно-восстановительная двойственность
В пробирку налить 1–2 см3 раствора KI, подкислить 2–3 каплями разбавленного раствора H2SО4 и прибавить 1–2 см3 Н 2О2. Наблюдать выделение йода… Опыт №2. Восстановительные свойства пероксида водорода В пробирку налить 1–2 см3 раствора КМnO4, подкислить 2–3 каплями разбавленного раствора H2SO4 и прибавить 1–2 см3…Типы окислительно-восстановительных реакций
Поместить в фарфоровую чашку немного цинковой пыли на кончике микрошпателя и прибавить туда же несколько кристаллов йода. Смесь перемешать. Для… Опыт №4. Реакции межмолекулярного взаимодействия. Окисление йодида солью… В пробирку налить 1–2 см3 раствора соли железа (3) и 1 см3 раствора KI. Содержимое пробирки разбавить дистиллированной…Направление окислительно-восстановительных реакций
В три пробирки налить по 1–2 мл раствора КМnO4, затем прибавить: в первую – 5 капель разбавленной серной кислоты, во вторую – 5 капель… а) во всех трёх случаях ион переходит в ион , причём оба иона являются… б) в кислой среде ион МnО-4 переходит в ион Мn2+Контрольные вопросы
1. Какие вещества могут быть:
а) только окислителями;
б) только восстановителями;
в) одновременно и окислителями и восстановителями? От чего это зависит?
2. Чем объяснить двойственность свойств пероксида водорода в окислительно-восстановительных реакциях?
3. Какие известны типы окислительно-восстановительных реакций?
4. Чем отличаются реакции межмолекулярного от реакций внутримолекулярного окисления-восстановления?
5. Привести 3 пары веществ, которые могут реагировать между собой по типу реакций окисления-восстановления с участием атомов одного и того же элемента в разных степенях окисления?
6.Какие из перечисленных веществ могут подвергаться диспропорционированию: КС1; NaNO2; CuSO4; I2; SO2; K2CrO4?
7. В какой среде КМnO4 является более сильным окислителем?
8. Почему изменением рН раствора можно добиться протекания окислительно-восстановительной реакции в обратном направлении?
9. Какой фундаментальный закон природы лежит в основе составления уравнений окислительно-восстановительных реакций методом электронно- ионного баланса?
Лабораторная работа № 11
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ
Ц е л ь р а б о т ы: познакомиться с устройством и принципом действия гальванического элемента, научиться определять ЭДС гальванических элементов.
О б о р у д о в а н и е и м а т е р и а л ы: растворы сульфата цинка, сульфата железа (II), хлорида олова (II), ацетата свинца, сульфата меди, нитрата серебра, серной кислоты; пластинки металлов: Zn, Fe, Sn, Pb, Cu; химические стаканы (150 см3); штатив с пробирками; электролитический ключ.
Методика выполнения
В шесть пробирок внести по 5–6 см3 растворов следующих солей: 1 – сульфат цинка; 2 – сульфат железа (II); 3 – хлорид олова (II); 4 – нитрат или… Во все пробирки опустить на 2–3 мин. по пластинке металлического цинка. Что… Вынуть цинковые пластинки. Провести аналогичные опыты с полосками олова, железа, свинца и меди.Результаты опытов
Заполнить таблицу данными своих наблюдений, поставив знак (+) под ионами металлов в тех случаях, когда эти металлы вытеснялись из их солей в… Расположить исследованные металлы в порядке убывания их восстановительной… Опыт №2. Изготовление гальванического элементаКонтрольные вопросы
1. Как изменяются восстановительные свойства металлов в зависимости от величины стандартных электродных потенциалов?
2. Объясните устройство, принцип работы и назначение водородного электрода.
3. Что называется поляризацией гальванического элемента?
4. Какие гальванические элементы называют концентрационными? Объясните принцип работы концентрационного элемента.
5. Работа гальванического элемента основана на протекании следующей реакции: Zn+NiCl2=ZnCl2+Ni. Напишите схему гальванического элемента; приведите уравнения катодного и анодного процессов.
6. Схема гальванического элемента имеет следующий вид: Sn/SnCl2//HCl/H2(Ag). Напишите уравнения катодного и анодного процессов.
 Лабораторная работа № 12
Лабораторная работа № 12
КОРРОЗИЯ МЕТАЛЛОВ И ЗАЩИТА ОТ НЕЁ
Ц е л ь р а б о т ы: ознакомиться с видами электрохимической коррозии и методами уменьшения скорости коррозии.
О б о р у д о в а н и е и м а т е р и а л ы: растворы 0,01 М и 1 М серной кислоты, 0,4 М уксусной кислоты, сульфата меди, железосинеродистого калия; штатив с пробирками, U-образные трубки, металлы: Zn, Sn, Cu,Fe, Al.
Методика выполнения
В стеклянную трубку, изогнутую под прямым углом, укреплённую в штативе, налить 0,01 М серной кислоты. С противоположных сторон введите цинковую и… Погрузить пластинки таким образом, чтобы они контактировали друг с другом. Что наблюдается при соприкосновении пластинок? При нарушении контакта между…Контрольные вопросы
1. Назовите типы коррозии металлов.
2. В каких условиях протекает электрохимическая коррозия?
3. Как влияют примеси металлов на скорость атмосферной коррозии железа?
4. Изменяется ли скорость коррозии металлов, находящихся в воде, если прилить раствор кислоты?
5. На поверхности железной пластинки имеется капля воды. Почему после её высыхания пятно ржавчины находится в центре капли?
6. Перечислите наиболее распространённые методы борьбы с коррозией?
7. Каков механизм протекторной защиты металлов от коррозии?
8. Какие вещества называют ингибиторами коррозии?
Лабораторная работа № 13
ЭЛЕКТРОЛИЗ РАСТВОРОВ ЭЛЕКТРОЛИТОВ
Ц е л ь р а б о т ы: ознакомимся с процессами, протекающими под действием электрического тока на электродах в электролитах различного состава. О б о р у д о в а н и е и м а т е р и а л ы: выпрямитель переменного тока…Методика выполнения работы
Опыт №1. Электролиз раствора хлорида двухвалентного олова Заполнить электролизер 0,5 М раствором двухвалентного олова. В оба колена… Окисление или восстановление происходит на катоде? Написать уравнение катодного и анодного процессов. Доказать…Контрольные вопросы
1. Что называется электролизом?
2. В чём различие процесса электролиза с растворимым и нерастворимым анодом?
3. Какой металл будет выделяться последним при электролизе раствора, содержащего К2SO4, СгС13, Fе2(SO4)3, Hg2(NO3)2, РЬ(NО3)2, если напряжение является достаточным?
4. Какой из металлов не будет выделятся из водных растворов: NiCl, CuCl2, CdCl2, CaCl2, СoCl2?
5. Какой из металлов в первую очередь будет выделяться из раствора его соли, если напряжение является достаточным для выделения этих металлов:
Fe, Си, Ag, Ni, Mn?
6. Приведите пример, когда при электролизе расплава электролита на аноде выделяется водород.
7. Какие законы количественно описывают процессы, протекающие при электролизе?
Лабораторная работа №14
СПОСОБЫ ВОДОПОДГОТОВКИ
Ц е л ь р а б о т ы: познакомиться с методами умягчения и обессоливания воды, получить практические навыки определения жёсткости воды, познакомиться… О б о р у д о в а н и е и м а т е р и а л ы: бюретка для титрования,…Методика выполнения
Умягчение воды
Временная жёсткость определяется путём титрования пробы воды раствором соляной кислоты. Для этого необходимо отмерить мерным цилиндром в две… Жвр.=, где Vк – объём кислоты, пошедший на титрование, см3 ;Контрольные вопросы
1. Что понимают под термином «жёсткость воды»?
2. Какие соли обусловливают временную и постоянную жёсткости воды?
3. В каких единицах измеряется жёсткость?
4. Указать методы умягчения и обессоливания воды.
5. Какими методами можно определить временную и постоянную жёсткости; какие реакции лежат в основе этих методов?
6. К 1 м3 воды прибавили 132,5 г карбоната натрия. На сколько ммоль/дм3 понизилась её жёсткость?
7. Опишите химизм обессоливания и объясните наблюдаемую при этом динамику изменения электропроводности водных растворов
Лабораторная работа №15
ОРГАНИЧЕСКИЕ ВЕЩЕСТВА И ПОЛИМЕРЫ
Ц е л ь р а б о т ы: получить и исследовать важнейшие свойства некоторых органических соединений и полимеров. О б о р у д о в а н и е и м а т е р и а л ы: штатив с пробирками,…Методика выполнения
Получение и свойства алифатических углеводородов
Поместить в пробирку тщательно измельчённую смесь, состоящую из ацетата натрия и гидроксида натрия в массовом соотношении 1:2. Пробирку закрыть… Опыт №2. Получение и свойства непредельных углеводородов на примере этилена и… В пробирку налить 1 см3 этанола и 3 см3 концентрированной Н2SO4. Пробирку закрыть пробкой-трубкой и осторожно нагреть…Характерные реакции кислородсодержащих органических соединений
В пробирку налить 2 см3 разбавленного раствора К2Сг2O7, 1 см3 2 М H2 SO4 и 1 см этанола. Смесь осторожно нагреть. Как изменяется цвет раствора?… ЗСН3СН2OН+К2Сг2О7+4Н2SO4=ЗСН3СНО+К2SO4+Сг2(SO4)3+7Н2O.Получение полимеров
Налить в пробирку 3 см3 метилметакрилата и прибавить 0,05 г инициатора реакций полимеризации - пероксида бензоила. Пробирку опустить в кипящую… Опыт №7. Получение фенолоформальдегидной (резольной) смолы Поместить в пробирку 3 г фенола, прилить 10 см3 раствора формальдегида (формалина) и 2 см3 концентрированного раствора…Контрольные вопросы
1. Чем обусловлены значительные различия в свойствах предельных и непредельных углеводородов?
2. Почему альдегиды окисляются значительно легче, чем кетоны?
3. По какому признаку и на какие классы делятся органические соединения?
4. Какие функциональные группы и сколько должны содержать органические вещества, чтобы их можно было использовать для получения полимеров?
5. Назовите отличительные признаки реакций полимеризации и поликонденсации.
Содержание
Введение 3
Общие правила работы в лаборатории 3
Лабораторная работа №1. Определение молярной массы эквивалента (эквивалентной массы) металла по объему вытесненного водорода 5
Лабораторная работа №2. Зависимость свойств элементов от их положения в периодической системе Д.И. Менделеева 8
Лабораторная работа №3. Определение тепловых эффектов химических процессов 10
Лабораторная работа №4. Приготовление растворов 14
Лабораторная работа №5. Определение молекулярной массы вещества криоскопическим методом 17
Лабораторная работа №6. Скорость химических реакций и химическое равновесие 20
Лабораторная работа №7. Водородный показатель среды. Гидролиз солей 25
Лабораторная работа №8. Электролитическая диссоциация. Произведение растворимости 27
Лабораторная работа №9. Получение и изучение свойств комплексных соединений 29
Лабораторная работа №10. Окислительно-восстановительные реакции 31
Лабораторная работа №11. Гальванический элемент 34
Лабораторная работа №12. Коррозия металлов и защита от
Нее 37
Лабораторная работа №13. Электролиз растворов электролитов 40
Лабораторная работа №14. Способы водоподготовки 42
Лабораторная работа №15. Органические вещества и полимеры 44
– Конец работы –
Используемые теги: таким, образом, курс, Общая, Химия, является, базовым, последующ, изучения, общепрофессиональных, специальных, дисциплин0.141
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Таким образом, курс Общая химия является базовым для последующего изучения общепрофессиональных и специальных дисциплин
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов