ХИМИЯ
ХИМИЯ - раздел Химия, Министерство Образования Российской Федерации Пермск...
Министерство образования Российской Федерации
Пермский государственный технический университет
Кафедра химии
ХИМИЯ
Методические указания, программа
и контрольные задания
Для студентов заочного обучения
Пермь 2000 г
Составители: Т.К.Томчук, С.А.Колесова, Л.Г.Черанева, М.М.Соколова, Н.Б.Ходяшев, Т.С.Соколова, Н.М.Чебыкина, Т.Г.Мальцева, И.С.Глушанкова,… УДК 541.1.Общие методические указания
Химия является одной из фундаментальных естественно – научных дисциплин. Знание химии позволяет получить современное научное представление о материи,… Основной вид учебных занятий студентов-заочников – самостоятельная работа над учебным материалом. По курсу химии она…Строение вещества
Строение атома
Квантовомеханическая модель атома. Двойственная корпускулярно-волновая природа электрона. Квантовые числа: главное, орбитальное, магнитное, спиновое. Атомная орбиталь. Заполнение уровней, подуровней, энергетических состояний (орбиталей). Принцип запрета Паули, правило Гунда. Нормальное и возбужденное состояние атомов и ионов. Атомные радиусы, энергия ионизации, сродство к электрону.
Периодическая система Д.И.Менделеева
Открытие периодического закона Д.И.Менделеева. Современная формулировка периодического закона. Периодическая система элементов как выражение… Периодическая система и ее связь со строением атомов. Последовательность… Изменение свойств химических элементов. Электроотрицательность. Окислительно-восстановительные свойства элементов.Химическая связь
Полярность связи. Полярные и неполярные молекулы. Дипольный момент связи и молекулы. Метод молекулярных орбиталей (ММО). Ионная связь. Электростатическое…Строение вещества в конденсированном состоянии
Твердое, жидкое, газообразное и плазменное состояние вещества. Водородная связь, силы межмолекулярного взаимодействия. Металлическая связь.
Строение твердого тела. Амфорные и кристаллические вещества. Кристаллическая решетка.
Координационное число. Классификация кристаллов по характеру химической связи в них. Атомная, ионная, молекулярная и металлическая решетки. Зависимость свойств кристаллических веществ от типа химической связи.
Основные закономерности протекания химических реакций
Энергетика химических реакций
Химическая термодинамика. Термодинамическая система. Свойства системы: внутренняя энергия, энтальпия, энтропия, энергия Гиббса. Теплота, работа. Тепловой эффект реакции. Теплота образования. Закон Гесса и следствия из него вытекающие. Стандартное состояние. Самопроизвольные процессы, критерии их протекания. Энергия Гиббса и энергия Гельмгольца и их изменение при химических процессах.
Химическая кинетика и равновесие
Скорость химических реакций. Гомогенные и гетерогенные системы. Факторы, влияющие на скорость химической реакции (концентрация, температура). Константа скорости. Энергия активации и энтропия активации. Химическое равновесие. Константа химического равновесия. Связь термодинамической константы равновесия со стандартным изменением энергии Гиббса. Принцип Ле Шателье. Катализ. Катализаторы.
Растворы
Растворы. Растворитель. Растворенное вещество. Классификация растворов. Способы выражения концентрации растворов. Разбавленные растворы неэлектролитов. Осмотическое давление. Уравнение… Давление насыщенного пара над раствором; закон Рауля. Температура кипения и кристаллизации. Криоскопия и…Электрохимические процессы
Электрохимические процессы. Электрод. Электродные потенциалы металлов (равновесные, неравновесные, стандартные). Ряд напряжений (активностей)… Гальванический элемент. Анодные и катодные процессы. ЭДС гальванического… Кинетика электродных процессов. Поляризация и перенапряжение. Концентрационная и электрохимическая поляризация.…Специальные разделы химии
Химия металлов
Зависимости свойств металлов от их положения в периодической системе Д.И.Менделеева.
Интерметаллические соединения и твердые растворы металлов. Основные методы получения металлов. Свойства р-элементов и их соединений. Свойства переходных металлов d-элементов IV –VII групп. Химия элементов семейства железа, их сплавы и химические соединения. Химия платиновых металлов. Химия металлов подгруппы меди и цинка.
Химия неметаллических элементов
Зависимость свойств неметаллов от их положения в периодической системе Д.И.Менделеева. Бор и его соединения. Углерод и его аллотропные формы. Карбонаты. Силикаты. Стекла. Ситаллы. Техническая и строительная керамика.
Элементы VI и VII групп и их соединения.
Химия вяжущих веществ
Определение и классификация вяжущих веществ и их свойства. Воздушные и гидравлические вяжущие вещества. Известковые и гипсовые вяжущие вещества. Портландцемент. Процессы схватывания и твердения. Бетон. Коррозия бетонов и методы борьбы с ней.
Химия воды
Строение молекул и свойства воды. Химические свойства воды. Взаимодействие воды с простыми веществами и химическими соединениями.
Природные воды и их состав. Жесткость воды. Умягчение и обессоливание воды.
ЛИТЕРАТУРА
Основная
1. Коровин Н.В. Общая химия. М.: Высшая школа, 1998.
2. Глинка Н.Л. Общая химии.Л.:Химия, 1988.
3. Фролов В.В. Химия. М.: Высшая школа, 1986.
4. Ахметов Н.С. Общая и неорганическая химия. М.: Высшая школа, 1998.
Дополнительная
1. Харин А.И. Курс химии. М.:Высшая школа, 1983. 2. Лучинский Г.П. Курс химии. М.: Высшая школа 1985. 3. Курс химии. Ч.2 (специальная для строительных вузов) / Под ред. В.А. Киреева. М.: Высшая школа, 1975.Молярная масса эквивалента
Молярная концентрация эквивалента раствора AlCI3 равна СН = 33,33/44,44×0,5 = 1,5 моль/л. Пример 4. Моляльность раствора.Гидролиз соли, образованной слабой кислотой и сильным основанием.
CH3COO– + Na+ + HOH = CH3COOH + Na+ + OH–, CH3COO– + HOH = CH3COOH + OH– – реакция среды щелочная. Продукт гидролиза – слабая кислота, реакция среды щелочная вследствие повышенной концентрации OH– -ионов..
Решение. Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса при помощи электронных уравнений. Вычисляем, как изменяют свою степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях:

 восстановитель 5 P3+–2 ē = P5+ процесс окисления;
восстановитель 5 P3+–2 ē = P5+ процесс окисления;
окислитель 2 Mn7++5 ē = Mn2+ процесс восстановления.
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которое присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов является число 10. Разделив это число на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Коэффициенты перед веществами, атомы которых не меняют свою степень окисления, находят подбором. Уравнение реакции будет иметь вид
2КMnО4 + 5Н3PO3 + 3H2SO4 = 2MnSO4 + 5Н3РО4 + K2SO4 + 3H2O.
Пример 4. Составьте уравнение реакции взаимодействия цинка с концентрированной серной кислотой, учитываz максимальное восстановление последней.
Решение. Цинк как любой металл проявляет только восстановительные свойства. В концентрированной серной кислоте окислительную функцию несет сера (+6). Максимальное восстановление серы означает, что она приобретает минимальную степень окисления. Минимальная степень окисления серы как р-элемента VI А группы равна –2. Цинк как металл II В группы имеет постоянную степень окисления +2. Отражаем сказанное в электронных уравнениях:
 4 Zn0 – 2 ē = Zn2+
4 Zn0 – 2 ē = Zn2+
1 S6+ + 8 ē = S2–
Составляем уравнение реакции:
4Zn + 5Н2SO4 = 4ZnSO4 + Н2S + 4Н2O.
Перед Н2SO4 стоит коэффициент 5, а не 1, ибо четыре молекулы Н2SO4 идут на связывание четырех ионов Zn2+.
201. Исходя из степени окисления хлора в соединениях НСl, НСlO3 НСlO4, определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
КВr + КBrО3 + Н2SО4 ® Вr2 + К2 SO4 + H2O.
202. Реакции выражаются схемами:
Р + НIO3 + Н2O ® Н3РО4 + Нl,
Н2S + Сl2+Н2O ® Н2SO4 + НСl.
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое восстановителем; какое вещество окисляется, какое – восстанавливается.
203. Составьте электронные уравнения и укажите, какой процесс – окисление или восстановление – происходит при следующих превращениях:
Аs3– ® As5+; N3+ ® N3–; S2– ® S0.
На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
Na2SO3 + КMnО4 + Н2O ® Nа2SO4 + МnО2 + КОН.
204. Исходя из степени окисления фосфора в соединениях РН3, Н3РO4, Н3РО3 определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме РbS + НNО3 ® S + Рb(NО3)2 + NO2 + Н2O.
205*. КMnО4 + Nа2SO3 + КОН ® К2МnО4 + Nа2SO4, + Н2О,
P + НNО3 +Н2O ® Н3PО4 + NO.
206. Составьте электронные уравнения и укажите, какой процесс – окисление или восстановление – происходит при следующих превращениях: Мn6+® Mn2+ ® Cl5+ ® Cl– ; N3– ® N5+. На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме Сu2O+НNO3®Сu(NО3)2 +NO+Н2О.
207*. НNO3 + Са ® NН4NО3 + Са(NO3)2 + Н2О,
К2S + КMnO4 + Н2SO4 ® S + К2SO4 + МnSO4 + Н2O.
208. Исходя из степени окисления хрома, йода и серы в соединениях К2Сr2О7, КI и Н2SО3 определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме:
NaCrО2 + РbО2 + NаОН ®Na2CrО4 + Nа2PbО2 + Н2О.
209*. Н2S + Сl2 + Н2O ® Н2SO4 + НСI,
К2Cr2О7 + Н2S + Н2SО4 ® S + Сr2 (SO4)3 + K2SO4 + H2O.
210*. KClO3 + Na2SO3 ® KCl + Na2SO4 ,
KMnO4 + HBr ® Br2 + KBr + MnBr2 + H2O.
211*. P + HClO3 + H2O ® H3PO4 + HCl,
H3AsO3 + KMnO4 + H2SO4 ® H3AsO4 + MnSO4 + K2SO4 + H2O.
212*.NaCrO2 + Br2 + NaOH ® 2Na2CrO4 + NaBr + H2O,
FeS + HNO3 ® Fe(NO3)2 + S + NO + H2O.
213*. HNO3 + Zn ® N2O + Zn(NO3)2 + H2O,
FeSO4 + KClO3 + H2SO4 ® Fe2(SO4)3 + KCl + H2O.
214*.K2Cr2O7 + HCl ® Cl2 + CrCl3 + KCl + H2O,
Au + HNO3 + HCl ® AuCl3 + NO + H2O.
215. Могут ли происходить окислительно-восстановительные реакции между веществами: а) NH3 и KMnO4; б) HNO2 и HI; в) НСl и H2Se? Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
KMnO4 + KNO2 + H2SO4 ® MnSO4 + KNO3 + K2SO4 + H2O.
216*. HCl + CrO ® Cl2 + CrCl3 + H2O,
Cd + KMnO4 + H2SO4 ® CdSO4 + K2SO4 + MnSO4 + H2O.
217*. I2 + NaOH ® NaOI + NaI,
MnSO4 + PbO2 + HNO3 ® HMNO4 + Pb(NO3)2 + PbSO4 + H2O.
218*. H2SO3 + HClO3 ® H2SO4 + HCl,
FeSO4 + K2Cr2O7 + H2SO4 ® Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O.
219*. I2 + Cl2 + H2O ® HIO3 + HCl,
FeCO3 + KMnO4 + H2SO4 ® Fe2(SO4)3 + CO2 + MnSO4 + К2SO4 + H2O.
220. Могут ли происходить окислительно-восстановительные реакции между веществами: а) РН3 и НВr; б) K2Cr2O7 и H3PO3; в) HNO3 и H2S? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей посхеме AsH3 + HNO3 ® H3AsO4 + NO2 + H2O.
Электродные потенциалы и электродвижущие силы*
Если металлическую пластинку опустить в воду, то расположенные на ее поверхности катионы металла будут гидратироваться полярными молекулами воды и переходить в жидкость. При этом электроны, в избытке остающиеся в металле, заряжают его поверхностный слой отрицательно. Возникает электростатическое притяжение между перешедшими в жидкость гидратированными катионами и поверхностью металла. В результате этого в системе устанавливается подвижное равновесие:
Me + mH2O=Me(H2O)n+m + ne–,
в растворе на металле
где n - число электронов, принимающих участие в процессе. На границе металл - жидкость возникает двойной электрический слой, характеризующийся определенным скачком потенциала — электродным потенциалом. Абсолютные значения электродных потенциалов измерить не удается. Электродные потенциалы зависят от ряда факторов (природы металла, концентрации, температуры и др.). Поэтому обычно определяют относительные электродные потенциалы в определенных условиях, называемых стандартными электродными потенциалами (Е°).
Стандартным электродным потенциалом металла называют его электродный потенциал, возникающий при погружении металла в раствор собственного иона с концентрацией или активностью, равной 1 моль, измеренный по сравнению со стандартным водородным электродом, потенциал которого при 25°С условно принимается равным нулю (Е° = 0; DG0 = 0).
Располагая металлы в ряд по мере возрастания их стандартных электродных потенциалов (Е°), получаем так называемый “ряд напряжений”. Положение того или иного металла в ряду напряжений характеризует его восстановительную способность, а также окислительные свойства его ионов в водных растворах при стандартных условиях. Чем меньше значение Е°, тем большими восстановительными способностями обладает данный металл в виде простого вещества и тем меньше окислительные способности проявляют его ионы. И наоборот. Электродные потенциалы измеряют в приборах, которые получили название гальванических элементов. Окислительно-восстановительная реакция, которая лежит в основе работы гальванического элемента, протекает в направлении, в котором ЭДС с. элемента имеет положительное значение. В этом случае DG0 < 0, так как DG0 = -nFE°.
Пример 1. Стандартный электродный потенциал никеля больше, чем у кобальта (табл. 4). Изменится ли это соотношение, если измерить потенциал никеля в растворе его ионов с концентрацией 0,001 моль/л, а кобальта – 0,1 моль/л?
Решение. Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
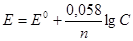 ,
,
где Е'° - стандартный электродный потенциал; п- число электронов, принимающих участие в процессе; С - концентрация (при точных вычислениях – активность) гидратированных ионов металла в растворе, моль/л. Е° для никеля и кобальта соответственно равны -0,25 и -0,277 В. Определим электродные потенциалыэтих металлов при данных в условии концентрациях:
Е(Ni2+/Ni)= -0,25 + (0,058/2)lg10–3 = -0,337 B,
Е(Co2+/Co)= -0,277 + (0,058/2)lg10–1 = -0,306 B.
Таким образом, при изменившейся концентрации потенциал кобальта стал больше потенциала никеля.
Таблица 4
Стандартные электродные потенциалы Е° некоторых металлов
(ряд напряжений)
| Электрод | Е° , В | Электрод | Е° , В |
| Li+/Li | -3,045 | Cd2+/Cd | -0,403 |
| Rb+/Rb | -2,925 | Co2+/Co | -0,277 |
| K+/K | -2,924 | Ni2+/Ni | -0,25 |
| Cs+/Cs | -2,923 | Sn2+/Sn | -0,136 |
| Ba2+/Ba | -2,90 | Pb2+/Pb | -0,127 |
| Ca2+/Ca | -2,87 | Fe3+/Fe | -0,037 |
| Na+/Na | -2,714 | 2H+/H2 | -0,000 |
| Mg2+/Mg | -2,37 | Sb3+/Sb | +0,20 |
| Al3+/Al | -1,70 | Bi3+/Bi | +0,215 |
| Ti2+/Ti | -1,603 | Cu2+/Cu | +0,34 |
| Zr4+/Zr | -1,58 | Cu+/Cu | +0,52 |
| Mn2+/Mn | -1,18 | Hg2+2/2Hg | +0,79 |
| V2+/V | -1,18 | Ag+/Ag | +0,80 |
| Cr2+/Cr | -0,913 | Hg2+/Hg | +0,85 |
| Zn2+/Zn | -0,763 | Pt2+/Pt | +1,19 |
| Cr3+/Cr | -0,74 | Au3+/Au | +1,50 |
| Fe2+/Fe | -0,44 | Au+/Au | +1,70 |
Пример 2. Магниевую пластинку опустили в раствор его соли. При этом электродный потенциал магния оказался равен -2,41 В. Вычислите концентрацию ионов магния в моль/л.
Решение. Подобные задачи также решаются на основании уравнения Нернста (см. пример 1);

Пример 3. Составьте схему гальванического элемента, в котором электродами являются магниевая и цинковая пластинки, опущенные в растворы их ионов с активной концентрацией 1 моль/л. Какой металл является анодом, какой катодом? Напишите уравнение окислительно-восстановительной реакции, протекающей в этом гальваническом элементе, и вычислите его ЭДС.
Решение. Схема данного гальванического элемента
(-)Mg½Mg2+║Zn2+½Zn(+).
Вертикальная черта обозначает поверхность раздела между металлом и раствором, а две черточки - границу раздела двух жидких фаз - пористую перегородку (или соединительную трубку, заполненную раствором электролита). Магний имеет меньший потенциал(-2,37 В) иявляется анодом, на котором протекаетокислительный процесс:
Mg-2ē=Mg2+. (1)
Цинк, потенциал которого -0,763 В, - катод, т. е. электрод, на котором протекает восстановительный процесс:
Zn2+ + 2ē = Zn. (2)
Уравнение окислительно-восстановительной реакции, которая лежит в основе работы данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Mg + Zn2+ = Mg2+ + Zn.
Для определения электродвижущей силы - ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода. Так как концентрация ионов в растворе равна 1 моль/л, то ЭДС элемента равна разности стандартных потенциалов двух его электродов:
ЭДС = Е°(Zn2+/Zn) - Е°(Mg2+/Mg)= -0,763 - (-2,37)=1,607 B.
221. В один из сосудов с голубым раствором медного купороса поместили цинковую пластинку, а во второй – серебряную. В каком сосуде цвет раствора постепенно пропадает? Почему? Составьте электронные и молекулярное уравнения соответствующей реакции.
222. Увеличится, уменьшится или останется без изменения масса цинковой пластинки при взаимодействии ее с растворами: a) CuSO4 ; б) MgSO4; в) Pb(NO3)2 ? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
223. При какой концентрации ионов Zn2+ (моль/л), потенциал цинкового электрода будет на 0,015 В меньше его стандартного электродного потенциала.
Ответ: 0,30 моль/л.
224. Увеличится, уменьшится или останется без изменения масса кадмиевой пластинки при взаимодействии ее с растворами: a) AgNO3; б) ZnSO4; в) NiSО4? Почему? Составьте электронные и молекулярные уравнений соответствующих реакций.
225. Марганцевый электрод в растворе его соли имеет потенциал -1,23 В. Вычислите концентрацию ионов Мn2+ в моль/л.
Ответ: 1,89×10–2 моль/л.
226. Потенциал серебряного электрода в растворе AgNO3 составил 95% от величины его стандартного электродного потенциала. Чему равна концентрация ионов Ag+ в моль/л?
Ответ: 0,20 моль/л.
227. Никелевый и кобальтовый электроды опущены соответственно в растворы Ni(NО3)2 и Co(NO3)2. В каком соотношении должна быть концентрация ионов этих металлов, чтобы потенциалы обоих электродов были одинаковыми?
Ответ: СNi2+: CCo2+» 0,117.
228. Составьте схемы двух гальванических элементов, в одном из которых медь была бы катодом, а в другом – анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде.
229. При какой концентрации ионов Сu2+ в моль/л значение потенциала медного электрода становится равным стандартному потенциалу водородного элемента?
Ответ: 1,89×10–12 моль/л.
230. Какой гальванический элемент называется концентрационным? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из серебряных электродов, один из которых погружен в 0,01 М, а второй, – в 0,1 М растворы AgNO3.
Ответ: 0,058 В.
231. При каком условии будет работать гальванический элемент, электроды которого сделаны из одного и того же металла? Составьте схему, напишите, электронные уравнения электродных процессов и вычислите ЭДС, гальванического элемента, в котором один никелевый электрод находится в 0,001 М растворе, а другой такой же электрод - в 0,01 М растворе сульфата никеля.
Ответ: 0,029 В.
232. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальваническою элемента, состоящего из свинцовой и магниевой пластин, опущенных в растворы своих солей с концентрацией СРb2+ = СМg2+ = 0.01 моль/л. Изменится ли ЭДС этого элемента, если концентрацию каждого из ионов увеличить в одинаковое число раз?
Ответ: 2,244 В.
233. Составьте схемы двух гальванических элементов, в одном из которых никель является катодом, а в другом – анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде.
234. Железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты. Составьте схему данного гальванического элемента, напишите электронные уравнения процессов, происходящих на аноде и на катоде.
235. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из пластин кадмия и магния, опущенных в растворы своих солей с концентрацией СMg2+ = МCd2+ = 1 моль/л. Изменится ли величина ЭДС, если концентрацию каждого из ионов понизить до 0,01 моль/л?
Ответ: 1,967 В.
236. Составьте схему гальванического элемента, состоящего из пластин цинка и железа, погруженных в растворы их солей. Напишите электронные уравнения процессов, протекающих на аноде и на катоде. Какой концентрации надо было бы взять ионы железа (в моль/л), чтобы ЭДС элемента стала равной нулю, если СZn2+ = 0,001 моль/л?
Ответ: 7,3×10-15 моль/л.
237. Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению:
Ni + Pb(NO3)2 = Ni(NO3)2 + Рb.
Напишите электронные уравнения анодного и катодного процессов. Вычислите ЭДС этого элемента, если СNi2+= 0,01 моль/л, СPb2+ = 0,0001 моль/л.
Ответ: 0.066 В.
238. Какие химические процессы протекают в электродах при зарядке и разрядке свинцового аккумулятора?
239. Какие химические процессы протекают на электродах при зарядке и разрядке кадмийникелевого аккумулятора?
240. Какие химические процессы протекают на электродах при зарядке и разрядке железоникелевого аккумулятора?
Электролиз
Электролизом называют совокупность химических процессов, которые протекают под действием электрического тока на электродах, погруженных в раствор или расплав электролита. Например, если в расплав хлорида натрия погрузить инертные электроды и пропустить постоянный электрический ток, то ионы будут двигаться к электродам: катионы Na+ - к катоду; анионы Cl– - к аноду.
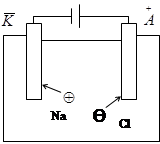 На катоде протекает процесс восстановления:
На катоде протекает процесс восстановления:
Na+ + ē = Na,
на аноде – процесс окисления:
2Cl– – 2ē = Cl2. Суммарная реакция:
 2Na+ + 2Cl– 2Na + Cl2 или
2Na+ + 2Cl– 2Na + Cl2 или
2NaCl 2Na + Cl2.
При электролизе водных растворов в процессах могут участвовать молекулы воды. Тогда на катоде может происходить восстановление ионов металла и водорода.
Рассматривая катодные процессы, протекающие при электролизе водных растворов, нужно учитывать величину потенциала процесса восстановления ионов водорода. Этот потенциал зависит от концентрации ионов водорода [H+] и парциального давления водорода PH2.
 .
.
Обычно парциальное давление водорода РH2поддерживается равным нормальному атмосферному давлению, которое условно принимается за единицу (lg 1 = 0). Тогда
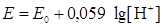 .
.
Поскольку стандартный потенциал процесса восстановления ионов водорода принимаем равным нулю, а lg[H+] = –pH, то получим
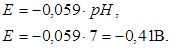
В нейтральных растворах (pH = 7) потенциал имеет значение K?
Поэтому, если катионом электролита является металл, электродный потенциал которого значительно положительнее, чем –0,41В, то из нейтрального раствора такого электролита на катоде будет выделяться металл. Такие металлы находятся в ряду напряжений вблизи водорода, начиная приблизительно с олова. Если катионом электролита является металл, имеющий потенциал значительно более отрицательный, чем –0,41В, металл восстанавливаться не будет, а произойдет выделение водорода. К таким металлам относятся металлы начала ряда напряжений, расположенные до титана. Наконец, если потенциал металла близок величине –0,41В (металлы средней части ряда напряжений – Zn, Cr, Fe, Cd, Ni), то в зависимости от концентрации раствора и условий электролиза возможно как восстановление металла, так и выделение водорода; нередко наблюдается совместное выделение металла и водорода.
Электрохимическое выделение водорода из кислых растворов, pH которых < 7, происходит вследствие разряда ионов водорода.
2H+ + 2ē = H2.
В случае же нейтральных или щелочных сред оно является результатом электрохимического восстановления воды: 2H2O + 2ē = H2 + 2OH–.
При рассмотрении анодного процесса следует иметь в виду, что материал анода в ходе электролиза может окисляться. В связи с этим различают электролиз с инертным анодом и электролиз с активным анодом. Инертным называется анод, материал которого не претерпевает окисления в ходе электролиза (чаще всего графит, уголь, платина, свинец).
На инертном аноде при электролизе происходит окисление воды с выделением кислорода. В щелочной среде уравнение имеет вид
4OH– – 4ē = O2 + 2H2O,
а в кислой и нейтральной:
2H2O – 4ē = O2 + 4H+.
Кислородосодержащие анионы (SO24–, NO–2, SO32–) или не способны окисляться, или их окисление происходит при очень высоких потенциалах. Например, стандартный потенциал окисления иона SO24– до S2O82– равен 2,01 В, что значительно превышает потенциал окисления воды (1,23 В). При электролизе водных растворов бескислородных кислот и их солей у анода разряжаются анионы.
В случае активного анода число конкурирующих окислительных процессов возрастает до трех: электрохимическое окисление воды, разряд анионов и электрохимическое окисление металла анода (анодное растворение металла). Будет идти тот процесс, потенциал которого меньше. Например, при электролизе NiSO4 с никелевым анодом происходит процесс окисления металла: Ni – 2ē → Ni2+.
Пример 1. Сколько граммов меди выделится на катоде при электролизе раствора CuSO4 в течение 1 ч при силе тока 4 А?
Решение. Согласно законам Фарадея
т = Эit/96500, (1)
где m - масса вещества, окисленного или восстановленного на электроде; Э – грамм-эквивалент вещества; i- сила тока; t- продолжительность электролиза, с.
Грамм-эквивалент меди в CuSO4 равен 63,54/2 = 31,77 г. Подставив в формулу (1) значения Э = 31,77, i = 4A, t = 60×60 = 3600 ч, получим
m = (31,77×4×3600)/96500 = 4,74 г.
Пример 2. Вычислить эквивалент металла, зная, что при электролизе раствора хлорида этого металла затрачено 3880 Кл электричества и на катоде выделяется 11,742 г металла.
Решение. Из формулы (1)
Э = 11,742×96500/3880 = 29,35,
где m=11,742 г; it = Q=3880 Кл.
Пример 3. Чему равна сила тока при электролизе раствора в течение 1 ч 40 мин 25 с, если на катоде выделилось 1,4 л водорода, измеренного при нормальных условиях?
Решение. Из формулы (1)
i = m×96500/Эt.
Так как количество водорода дано в объемных единицах, то отношение т/Э заменяем отношением VH2 /Vг-экв Н2, где VH2- объем водорода в литрах; Vг-экв Н2- объем грамм-эквивалента водорода в литрах. Тогда
i= VH2×96500/ Vг-экв Н2t.
Объем грамм-эквивалента водорода при н.у. равен половине грамм-молекулярного объема 22,4/2 = 11,2 л. Подставив в приведенную формулу значения VH2=1,4, Vг-экв Н2 = 11,2, t = 6025 (1 ч 40 мин 26 с = 6025 с), находим
i = 1,4 ´ 96500/11,2 ´ 6025 = 2 А.
Пример 4. Сколько граммов едкого кали образовалось у катода при электролизе раствора K2SO4, если на аноде выделилось 11,2 л кислорода, измеренного при нормальных условиях?
Решение. Объем грамм-эквивалента кислорода (н. у.) 22,4/4 = 5,6 л. Следовательно, 11,2 л составляют 2 г-экв кислорода. Столько же, т, е. 2 г-экв КОН образовалось у катода, или 56,11 ´ 2 = 112,22 г (56,11 г - г×экв КОН).
241. Электролиз раствора K2SО4 проводили при силе тока 5 А в течение 3 ч. Составьте электронные уравнения процессов, происходящих на электродах, вычислите объем выделяющихся на электродах веществ.
242. Составьте электронные уравнения процессов, происходящих на электродах при электролизе растворов AlCl3, NiSO4. В обоих случаях анод угольный.
243. При электролизе раствора CuSO4 на аноде выделилось 168 см3 кислорода, измеренного при н. у. Сколько граммов меди выделилось на катоде? Составьте электронные уравнения процессов, происходящих на электродах.
244. Сколько граммов воды разложилось при электролизе раствора Na2SO4 при силе тока 7 А в течение 5 ч? Составьте электронные уравнения процессов, происходящих на электродах.
245. Электролиз раствора нитрата серебра проводили при силе тока 2 А в течение 4 ч. Сколько граммов серебра выделилось на катоде? Составьте электронные уравнения процессов, происходящих на электродах.
246. Электролиз раствора сульфата некоторого металла проводили при силе тока 6 А в течение 45 мин, в результате чего на катоде выделилось 5,49 г металла. Вычислите эквивалент металла. Составьте электронные уравнения процессов, происходящих на электродах.
247. Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора КОН, расплава КОН.
248. Электролиз раствора сульфата цинка проводили в течение 5 ч, в результате чего выделилось 6 л кислорода, измеренного при н. у. Вычислите силу тока. Составьте электронные уравнения процессов, происходящих на электродах.
249. Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора А12(SO4)3 в случае угольного анода; в случае алюминиевого анода.
250. Какие вещества и в каком количестве выделятся на угольных электродах при электролизе раствора NaI в течение 2,5 ч, если сила тока равна 6 А? Составьте электронные уравнения процессов, происходящих на электродах.
251. При электролизе раствора AgNO3 масса серебряного анода уменьшилась на 5,4 г. Сколько электричества в кулонах израсходовано на этот процесс? Составьте электронные уравнения процессов, происходящих на электродах.
252. Какие вещества и в каком количестве выделяются на угольных электродах при электролизе раствора КВr в течение 1 ч 35 мин при силе тока 16 А? Составьте электронные уравнения процессов, происходящих на электродах.
253. Составьте электронные уравнения процессов, происходящих при электролизе CuCl2 , если анод медный; если анод угольный?
254. На электролиз раствора CaCl2 израсходовано 10722,2 Кл электричества. Вычислите массу выделяющихся на угольных электродах и образующегося возле катода веществ. Составьте электронные уравнения процессов, происходящих на электродах.
255. Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора КС1; расплава КС1.
256. Сколько времени проводят электролиз раствора электролита при силе тока 5 А, если на катоде выделяется 0,1 г-экв вещества? Сколько выделится вещества на аноде? Составьте электронные уравнения процессов, происходящих на электродах.
257. При электролизе растворов MgSO4 и ZnCl2 , соединенных последовательно с источником тока, на одном из катодов выделилось 0,25 г водорода. Сколько граммов вещества выделится на другом катоде; на анодах? Составьте электронные уравнения процессов, происходящих на электродах.
258.Чему равна сила тока, если при электролизе раствора MgCl2 в течении 30 мин на катоде выделилось 8,4 л водорода, измеренного при н. у. Вычислите массу вещества, выделяющегося на аноде. Составьте электронные уравнения процессов, происходящих на электродах.
259. Сколько граммов Н2SO4 образуется возле анода при электролизе раствора Na2SO4, если на аноде выделяется 1,12 л кислорода, измеренного при н. у.? Вычислите массу вещества, выделяющегося на катоде. Составьте электронные уравнения процессов, происходящих на электродах.
260.Вычислите силу тока, зная, что при электролизе раствора КОН в течение 1 ч 15 мин 20 с на аноде выделилось 6,4 г кислорода. Какое вещество и в каком количестве выделяется на катоде? Составьте электронные уравнения процессов, происходящих на электродах.
Коррозия металлов*
Коррозия – это самопроизвольно протекающий процесс разрушения металлов в результате химического или электрохимического взаимодействия их с окружающей средой.
При электрохимической коррозии на поверхности металла одновременно протекает два процесса:
анодный – окисление металла
Ме0 – n×ē = Men+,
катодный – восстановление ионов водорода
2H+ + 2ē = H2
или молекул кислорода, растворенного в воде
O2 + 2H2O +4ē = 4OH–.
Ионы или молекулы, которые восстанавливаются на катоде, называют деполяризаторами.
261. Как происходит атмосферная коррозия луженого и оцинкованного железа при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов.
262. Медь не вытесняет водород из разбавленных кислот. Почему? Однако, если к медной пластинке, опущенной в кислоту, прикоснуться цинковой, то на меди начинается бурное выделение водорода. Дайте этому объяснение, составив электронные уравнения анодного и катодного процессов. Напишите уравнение протекающей химической реакции.
263. Как происходит атмосферная коррозия луженого железа и луженой меди при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов.
264. Если пластинку из чистого цинка опустить в разбавленную кислоту, то начинающееся выделение водорода вскоре почти прекращается. Однако при прикосновении к цинку медной палочкой на последней начинается бурное выделение водорода. Дайте этому объяснение, составив электронные уравнения анодного и катодного процессов. Напишите уравнение протекающей химической реакции.
265. В чем заключается сущность протекторной защиты металлов от коррозии? Приведите пример протекторной защиты никеля в электролите, содержащем растворенный кислород. Составьте электронные уравнения анодного и катодного процессов.
266.Если на стальной предмет нанести каплю воды, то коррозии подвергается средняя, а не внешняя часть смоченного металла. После высыхания капли в ее центре появляется пятно ржавчины. Чем это можно объяснить? Какой участок металла, находящийся под каплей воды, является анодным и какой катодным? Составьте электронные и молекулярные уравнения соответствующих процессов.
267. Если гвоздь вбить во влажное дерево, то ржавчиной покрывается та его часть, которая находится внутри дерева. Чем это можно объяснить? Анодом или катодом является эта часть гвоздя? Составьте электронные уравнения соответствующих процессов.
268. В раствор соляной кислоты поместили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка происходит интенсивнее? Ответ мотивируйте, составив электронные уравнения соответствующих процессов.
269. Почему химически чистое железо является более стойким против коррозии, чем техническое железо? Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии технического железа во влажном воздухе и в сильнокислой среде.
270. Какое покрытиеметалла называется анодным и какое катодным? Назовите несколько металлов, которые могут служить для анодного и катодного покрытия железа. Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии железа, покрытого медью во влажном воздухе и в сильнокислой среде.
271. Железное изделие покрыли кадмием. Какое это покрытие – анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в соляной кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
272. Железное изделие покрыли свинцом. Какое это покрытие – анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в соляной кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
273. Две железные пластинки, частично покрытые одна оловом, другая медью, находятся во влажном воздухе. Обе ли пластинки подвержены коррозии? Почему? Составьте электронные уравнения возможных анодного и катодного процессов коррозии этих пластинок. Каков состав продуктов коррозии железа?
274. Железное изделие покрыли цинком. Какое это покрытие анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в разбавленной серной кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
275. Если пластинку из чистого железа опустить в соляную кислоту, то выделение на ней водорода идет медленно и со временем почти прекращается. Однако, если цинковой палочкой прикоснуться к железной пластинке, то на последней начинается бурное выделение водорода. Почему? Какой металл при этом растворяется? Составьте электронные уравнения анодного и катодного процессов.
276. Цинковую и железную пластинки опустили в раствор сульфата меди. Составьте электронные и ионные уравнения реакций, происходящих на каждой из этих пластинок. Какие процессы будут проходить на пластинках, если наружные концы их соединить проводником?
277. Как влияет рН среды на скорость коррозии железа и цинка? Почему? Составьте электронные уравнения анодного и катодного процессов атмосферной коррозии этих металлов.
278. В раствор электролита, содержащего растворенный кислород, опустили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка происходит интенсивнее? Составьте электронные уравнения анодного и катодного процессов.
279. Железные бочки применяют для транспортировки концентрированной серной кислоты, но после освобождения от кислоты бочки часто совершенно разрушаются вследствие коррозии. Чем это можно объяснить? Что является анодом и что катодом? Составьте электронные уравнения соответствующих процессов.
280.Как протекает атмосферная коррозия железа, покрытого слоем никеля, если покрытие нарушено? Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
s-элементы (...ns1-2)*
281. Какую степень окисления может проявлять водород в своих соединениях? Приведите примеры реакций, в которых газообразный водород играет роль окислителя, и в которых - роль восстановителя.
282. Напишите уравнения реакций натрия с водородом, кислородом, азотом и серой. Какую степень окисления приобретают атомы окислителя в каждой из этих реакций?
283. Напишите уравнения реакций с водой следующих соединений натрия:Na2O2 , Na2S , NaH , Na3N.
284. Как получают металлический натрий? Составьте электронные уравнения процессов, проходящих на электродах при электролизе расплава NaOH.
285.Какие свойства может проявлять перекись водорода в окислительно-восстановительных реакциях? Почему? На основании электронных уравнений напишите уравнения реакции Н2О2: а) с Ag2O; б) с KI.
286. Почему перекись водорода способна диспропорционировать (самоокисляться - самовосcтанавливаться)? Составьте электронные и молекулярные уравнения процесса разложения Н2О2.
287. Как можно получить гидрид и нитрид кальция? Напишите уравнения реакций этих соединений с водой. К окислительно-восстановительным реакциям составьте электронные уравнения.
288. Назовите три изотопа водорода. Укажите состав их ядер. Что такое тяжелая вода? Как она получается и каковы ее свойства?
289. Гидроксид какого из s-элементов проявляет амфотерные свойства? Составьте молекулярные и ионные уравнения реакций этого гидроксида: а) с кислотой; б) со щелочью.
290. При пропускании диоксида углерода через известковую воду (раствор (Са(ОН)2) образуется осадок, который при дальнейшем пропускании СО2 растворяется. Дайте объяснение этому явлению. Составьте уравнения реакций.
291. Составьте электронные и молекулярные уравнения реакций: а) бериллия с раствором щелочи; б) магния с концентрированной серной кислотой, имеяв видумаксимальное восстановление последней.
292. При сплавлении оксид бериллия взаимодействует с диоксидом кремния и с оксидом натрия. Напишите уравнения соответствующих реакций. О каких свойствах ВеО говорят эти реакции?
293. Какие соединения магния и кальция применяются в качестве вяжущих строительных материалов?Чемобусловлены их вяжущие свойства?
294. Как можно получить карбид кальция? Что образуется при его взаимодействии с водой? Напишите уравнения соответствующих реакций.
295. Как можно получить гидроксиды щелочных металлов? Почему едкие щелочи необходимо хранить в хорошо закрытой посуде? Составьте уравнения реакций, происходящих при насыщении едкого натра: а) хлором; б) сернистым ангидридом; в) сероводородом.
296. Чем можно объяснить большую восстановительную способность щелочных металлов? При сплавлении едкого натра с металлическим натрием последний восстанавливает водород щелочи в гидрид-ион. Составьте электронные и молекулярное уравнения этой реакции.
297. Какое свойство кальция позволяет применять его в металлотермии для получения некоторых металлов из их соединений? Составьте электронные и молекулярные уравнения реакций кальция: а) с V2O5; б) с СаSO4. В каждой из этих реакций окислитель восстанавливается максимально, приобретая низшую степень окисления.
298. Какие соединения называются негашеной и гашеной известью? Составьте уравнения реакций ихполучения. Какое соединение образуется при накаливании негашеной извести с углем? Что является окислителем и восстановителем в последней реакции? Составьте электронные и молекулярные уравнения.
299. Составьте электронные и молекулярные уравнения реакций: а) кальция с водой; б) магния с азотной кислотой, учитывая максимальное восстановление последней.
300. Составьте уравнения реакций, которые нужно провести для осуществления следующих превращений;
Са ® СаH2 ® Ca(ОН)2 ® СаСО3 ® Сa(НCO3)2.
Жесткость воды и методы ее устранения
Пример 1. Вычислить жесткость воды, зная, что в 500 л ее содержится 202,5 г Са(НСO3)2.
Решение. В 1л воды содержится 202,5 : 500 = 0,405 г Са(НСО3)2, что составляет 0,405 : 81 = 0,005 г-экв, или 5 мг-экв (81—эквивалент Са(НСО3)2). Следовательно, жесткость воды 5 мг-экв.
Пример 2. Сколько граммов СаSO4 содержится в 1 м3 воды, если жесткость, обусловленная присутствием этой соли, равна 4 мг-экв?
Решение. Грамм-молекула СаSO4 136,14 г; грамм-эквивалент равен половине грамм-молекулы, т. е. 68,07 г., а миллиграмм-эквивалент 68,07 мг. В 1 м3 воды с жесткостью 4 мг-экв содержится 4×1000 = 4000 мг-экв, или 4000×´ ×68,07 = 272280 мг = 272,280 г СаSO4.
Пример 3. Сколько граммов соды надо прибавить к 500 л воды, чтобы устранить ее жесткость, равную 5 мг-экв?
Решение. В 500 л воды содержится 500 × 5 = 2500 мг-экв или 2,5 г-экв солей, обусловливающих жесткость воды. Для устранения жесткости следует прибавить 2,5 × 53 = 132,5 г cоды (53 г – г-экв Na2CO3).
Пример 4. Вычислить карбонатную жесткость воды, зная, что на титрование 100 см3 этой воды, содержащей гидрокарбонат кальция, потребовалось 6,25 см3 0,08 н раствора НСl.
Решение. Вычисляем нормальность раствора гидрокарбоната кальция. Обозначив число грамм-эквивалентов растворенного вещества в 1 л раствора, т. е. нормальность, через х, составляем пропорцию:

Таким образом, в 1 л исследуемой воды содержится 0,005×1000 = 5 мг-экв гидрокарбоната кальция или 5 мг-экв Са2+-ионов. Карбонатная жесткость воды 5 мг-экв.
Приведенные примеры решают, используя формулу
Ж=т/ЭV,
где m - масса вещества, обусловливающего жесткость воды или применяемого для устранения жесткости воды, мг; Э - эквивалент этого вещества; V - объем воды, л.
Решение примера 1.
Ж = т/ЭV = 202500/81×500 = 5 мг-экв.
81 - эквивалентСа(НСО3)2, равный половине егомолекулярного веса.
Решение примера 2. Из формулы Ж = m/ЭV = 4 68,07×1000 = 272280 мг = 272,280 г СаSO4.
301. Сколько граммов Na3РO4 надоприбавить к 500 л воды, чтобы устранятьее карбонатнуюжесткость, равную5 мг-экв?
302.Какие соли обуслoвливают жесткость природной воды? Какую жесткость называют карбонатной,некарбонатной? Как можно устранить карбонатную, некарбонатную жесткость? Напишите уравнения соответствующих реакций.
303. Вычислите карбонатную жесткость воды, зная, что для реакции с гидрокарбонатом кальция, содержащимся в 200 см3 воды, требуется 15 см3 0,08 н., раствора НСl.
304. В 1 л воды содержится 36,47 мг-ион магния и 50,1 мг-ион кальция. Чему равна жесткость этой воды?
305. Сколько граммов карбоната натрия надо прибавить к 400 л воды, чтобы устранить жесткость, равную 3 мг-экв?
306. Вода содержащая только сульфат магния, имеет жесткость 7 мг-экв. Сколько граммов сульфата магния содержится в 300 л этой воды?
307. Вычислите жесткость воды, зная, что в 600 л еесодержатся 65,7 г гидрокарбоната магния и 61,2 г сульфата кальция.
308.В 220 л воды содержится 11 г сульфатамагния.Чему равна жесткость этой воды?
309.Жесткость воды, в которой растворен только гидрокарбонат кальция, равна 4 мг-экв. Сколько 0,1 н. раствора НСI потребуется для реакции с гидрокарбонатом кальция, содержащимся в 75 см3 этой воды?
300. В 1 м3 воды содержится140 г сульфата магния.Вычислите жесткость этой воды.
311. Вода, содержащая только гидрокарбонат магния, имеет жесткость 3,5 мг-экв. Сколько граммов гидрокарбоната магния содержится в 200 л этой воды?
312. К 1 м3 жесткой воды прибавили 132,5 г карбоната натрия. На сколько миллиграмм-эквивалентов понизилась жесткость?
313. Чему равна жесткость воды, если для ее устранения к 50 л воды потребовалось прибавить 21,2 г карбоната натрия?
314. Сколько граммов СаSO4 содержится в 200 л воды, если жесткость, обусловливаемая этой солью, равна 8 мг-экв?
315. Вода, содержащая только гидрокарбонат кальция, имеет жесткость 9 мг-экв. Сколько граммов гидрокарбоната кальция содержится в 600 л этой воды?
316. Какие надо удалить ионы из природной воды, чтобы сделать ее мягкой? Введением каких ионов можно умягчить воду? Составьте уравнения соответствующих реакций.
317. Сколько граммов карбоната натрия надо прибавить к 0,1 м3 воды, чтобы устранить жесткость, равную 4 мг-экв?
318. К 100 л жесткой воды прибавили 12, г гидроксида кальция. На сколько миллиграмм-эквивалентов понизилась карбонатная жесткость?
319. Чему равна карбонатная жесткость воды, если в 1 л ее содержится 0,292 г гидрокарбоната магния и 0,2025 г гидрокарбоната кальция?
320. Сколько граммов гидроксида кальция надо прибавить к 275 л воды, чтобы устранитьее карбонатную жесткость, равную 5,5 мг-экв?
p-элементы (…ns2 nр1-6)*
321. Составьте уравнения реакций, которые нужно провести, для осуществления следующих превращений:
Аl ® Al2(SO4)3 ® Na[Al(OH)4] ® Al(NO3)3.
322. Составьте электронные и молекулярные уравнения реакций: а) алюминия с раствором щелочи; б) бора с концентрированной азотной кислотой.
323. Какой процесс называется алюминотермией? Составьте электронные и молекулярное уравнения реакции, восстановления металлического хрома из оксида хрома (III) алюминием.
324. Составьте уравнения реакций, которые нужно провести для осуществления следующих превращений: В ® Н3ВО3 ® Nа2В4O7 ® H3ВО3. Уравнение окислительно-восстановительной реакции составьтена основании электронных уравнений.
325. Какая степень окисления наиболее характерна для олова и какая для свинца? Составьте электронные и молекулярные уравнения реакций олова и свинца с концентрированной азотной кислотой.
326. Чем можно объяснить восстановительные свойства соединений олова (+2) и окислительные – cвинца (+4)? На основании электронных уравнений составьте уравнения реакций: а) SnCl2 с НgСl2; б) РbО2 с НСlконц.
327. Какие оксиды и гидроксиды образуют олово и свинец? Как изменяются их кислотно-основные и окислительно-восстановительные свойства в зависимости от степени окисления элементов? Составьте молекулярные и ионные уравнения реакций взаимодействия раствора едкого натра: а) с оловом; б) с дигидроксидом свинца.
328. При высокой температуре алюминий взаимодействует с азотом, серой и углеродом. Напишите электронные и молекулярные реакции получения нитрида, сульфида и карбида алюминия. Какие продукты образуются при взаимодействии этих соединений с водой?
329. На основании электронных уравнений составьте уравнение реакции фосфора с азотной кислотой, учитывая, что фосфор окисляется максимально, а азот восстанавливается минимально.
330. Почему атомы большинства р-элементов способны к реакциям диспропорционирования (самоокисления – самовосстановления) ? На основании электронных уравнений напишите уравнение реакции растворения серы в концентрированном растворе щелочи. Один из продуктов содержит серу со степенью окисления +4.
331. Почему сернистая кислота может проявлять как окислительные, так и восстановительные свойства? На основании электронных уравнений составьте уравнения реакций Н2SO3: а) с сероводородом; б) с хлором.
332. Какие свойства проявляет сероводород в окислительно-восстановительных реакциях? Почему? Составьте электронные и молекулярные, уравнения реакций взаимодействия раствора сероводорода: а) с хлором; б) с кислородом.
333. Почему азотистая кислота может проявлять как окислительные, так и восстановительные свойства? На основании электронных уравнений составьте уравнения реакций НNO2: а) с бромной водой; б) с НI.
334. Почему диоксид азота способен к реакциям самоокисления — самовосстановления (диспропорционирования)? На основании электронных уравнений напишите уравнение реакции растворения NО2 в едком натре.
335. Какие свойства в окислительно-восстановительных реакциях проявляет серная кислота? Напишите уравнения реакций взаимодействия разбавленной серной кислоты с магнием и концентрированной – с медью. Укажите окислитель и восстановитель.
336. В каком газообразном соединении азот проявляет свою низшую степень окисления? Напишите уравнения реакций получения этого соединения: а) при взаимодействии хлорида аммония с гидроксидом кальция; б) разложением нитрида магния водой.
337. Почему фосфористая кислота способна к реакциям самоокисления – самовосстановления (диспропорционирования)? На основании электронных уравнений составьте уравнение процесса разложения Н3РО3, учитывая, что при этом фосфор приобретает минимальную и максимальную степень окисления.
338. В каком газообразном соединении фосфор проявляет свою низшую степень окисления? Напишите уравнения реакций: а) получения этого соединения при взаимодействии фосфида кальция с соляной кислотой; б) горения его в кислороде.
339. Какую степень окисления могут проявлять мышьяк, сурьма и висмут в соединениях? Какая степень окисления является более характерной для каждого из них? Почему? Составьте электронные и молекулярные уравнения реакций: а) мышьяка с концентрированной азотной кислотой; б) висмута с концентрированной серной кислотой.
340. Как изменяются окислительные свойства галогенов при переходе от фтора к иоду и восстановительные свойства их отрицательно заряженных ионов? Почему? Составьте электронные и молекулярные уравнения реакций: а) Сl2 + l2 + H2O = ?; б) Кl + Вr2 =. Укажите окислитель и восстановитель.
341. Составьте электронные и молекулярные уравнения реакции, происходящей при пропускании хлора через горячий раствор едкого кали. К какому типу окислительно-восстановительных процессов относится данная реакция?
342. Какие реакции нужно провести для осуществления следующих превращений: NаСl ® НСl ® Cl2 ® КСlO3. Уравнения окислительно-восстано-вительных реакций составьте на основании электронных уравнений.
343. К раствору, содержащему SbСl3 и ВiСl3, добавили избыток раствора едкого кали. Напишите молекулярные и ионные уравнения происходящих реакций. Какое вещество находится в осадке?
344. Чем существенно отличается действие разбавленной азотной кислоты на металлы от действия соляной и разбавленной серной кислот? Что является окислителем в первом случае, что – в двух других. Приведите примеры.
345. Напишите формулы и назовите кислородные кислоты хлора, укажите степень окисления хлора в каждой из них. Какая из этих кислот является более сильной? Почему? Какие свойства проявляет соли этих кислот в окислительно-восстановительных реакциях? Приведите примеры.
346. Напишите формулы оксидов азота в различных степенях окисления. Какие из оксидов являются кислотообразующими? Составьте формулы соответствующих кислот. Какие свойства может проявлять азотистая кислота и ее соли в окислительно-восстановительных реакциях? Составьте электронные уравнения следующих реакций:
KNO2 + Cl2 + H2O → KNO3 + HCl,
KNO2 + KI + H2SO4 → NO + I2 + K2SO4 + H2O.
347. Какую степень окисления может проявлять кремний в своих соединениях? Составьте уравнения реакции, которые надо провести для осуществления следующих превращений: Мg2Si ® SiH4 ® SiO2 ® К2SiO3. При каком превращении происходит окислительно-восстановительная реакция?
348. Какое применение находит кремний? Составьте уравнения реакции, которые надо провести для осуществления следующих превращений: SiO2 ® Si ® K2SiO3 ® H2SiO3. Окислительно-восстановительные реакции напишите на основании электронных уравнений.
349. Как получают диоксид углерода в промышленности и в лаборатории? Напишите уравнения соответствующих реакций и реакций, при помощи которых можно осуществить следующие превращения: NаНСО3 ® СО2 ® CaCO3 ® Cа(НСО3)2.
350. Какие из солей угольной кислоты имеют наибольшее промышленное применение? Как получить соду исходя из металлического натрия, соляной кислоты, мрамора и воды? Почему в растворе соды лакмус приобретает синий цвет? Ответ подтвердите составлением уравнений соответствующих реакций.
351.Как изменяются основные и кислотные свойства в ряду гидрооксидов мышьяка (III), сурьмы (III) и висмута (III)? Как можно практически отделить друг от друга малорастворимые Sb(OH)3 и Bi(OH)3? Напишите уравнения соответствующих реакций.
352. Напишите уравнение реакции окисления арсенита натрия перманганатом калия в щелочной среде и определите объем 0,1 М KMnO4, необходимый для окисления 2,5 г Na3AsO3.
353. Напишите уравнение реакции взаимодействия перманганата калия с йодидом калия в сернокислом растворе. Какая масса йода выделится, если в реакцию вступило 0,3 л раствора перманганата калия (ρ = 1040 кг/м3) с массовой долей KMnO4 6 %.
354. Какие свойства окислительные или восстановительные проявляет оксид углерода (II)? Написать уравнения соответствующих реакций.
355. Исходя из строения атомов галогенов, указать, какие валентные состояния характерны для фтора, хлора, брома и йода. Какие степени окисления проявляют галогены в своих соединениях? Приведите примеры.
356.Закончите уравнения реакций:
а) H2S + SO2 → б) KМnO4 +SO2 + H2O →
Расставьте коэффициенты в уравнениях реакций. Укажите, какие свойства проявляет в каждой из этих реакций диоксид серы.
357. Что называют царской водкой? Какими свойствами она обладает? Напишите уравнение реакции взаимодействия царской водки с золотом.
358. Какие соединения называются карбидами и силицидами? Напишите уравнения реакций: а) карбида алюминия с водой; б) силицида магния с соляной кислотой. Являются ли эти реакции окислительно-восстановительными? Почему?
359. Почему раствор SbCl3 мутнеет при разбавлении водой? Как сделать его снова прозрачным не фильтруя? Составить в молекулярной и ионно-молекулярной форме уравнения происходящих реакций.
360. Как относятся к нагреванию следующие соли аммония: хлорид, сульфат, дихромат, нитрат, нитрит, карбонат? Составьте соответствующие уравнения реакций.
d- элементы ((n-1)d1-10 ns0-2)
361. Серебро не взаимодействует с разбавленной серной кислотой, тогда как в концентрированной оно растворяется. Чем это можно объяснить? Составьте электронные и молекулярные уравнения соответствующей реакции.
362. Составьте уравнения реакций, которые надо провести для осуществления следующих превращений:
Cu ® Cu(NO3)2 ® Cu(OH)2 ® CuCl2 ® [Cu(NH3)4]Cl2.
363.Составьте электронные и молекулярные уравнения реакций взаимодействия цинка: а) с раствором едкого натра; б) с концентрированной серной кислотой, учитывая восстановление серы до нулевой степени окисления.
364. Составьте уравнения реакций, которые надо провести для осуществления следующих превращений:
Zn ® ZnSO4 ® Zn(OH)2 ® ZnO ® Na2ZnO2.
365.При прибавлении раствора щелочи к раствору MnSO4 выпадает белый осадок, который медленно буреет на воздухе. Составьте молекулярные и ионные уравнения реакций. В окислительно-восстановительной реакции составьте уравнения электронного баланса.
366. Составьте молекулярные и электронные уравнения реакций, которые нужно провести для осуществления следующих превращений:
Mn ® Mn(NO3)2 ® MnO2 ® MnCl2.
Какие окислительно-восстановительные свойства проявляют в этих реакциях соединения марганца?
367. Составьте молекулярные и ионные уравнения реакций взаимодействия растворов следующих веществ, если одним из продуктов во всех случаях является осадок Cr(OH)3:
а) CrCl3 + CH3COONa + H2O =
б) CrCl3 + NaOH =
в) Na2CrO4 + Na2S + H2O =
368. К какому классу соединений относятся вещества, полученные при действии избытка едкого натра на растворы ZnCl2, CdCl2, HgCl2? Составьте молекулярные и ионные уравнения соответствующих реакций.
369.При действии на титан концентрированной соляной кислоты образуется трихлорид титана, а при действии азотной – осадок метатитановой кислоты. Составьте электронные и молекулярные уравнения соответствующих реакций.
370.При растворении титана в концентрированной серной кислоте последняя восстанавливается минимально, а титан переходит в катион с максимальной степенью окисления. Составьте электронные и молекулярные уравнения соответствующих реакций.
371. Какую степень окисления проявляют медь, серебро и золото в соединениях? Какая степень окисления наиболее характерна для каждого из них? Йодид калия восстанавливает ионы меди (+2) в соединения меди со степенью окисления +1. Составьте электронные и молекулярные уравнения KI с сульфатом меди.
372.Диоксиды титана и циркония при сплавлении взаимодействуют со щелочами. О каких свойствах оксидов говорят эти реакции? Напишите уравнения реакций между: a) TiO2 и BaO; б)ZrO2 и NaOH. В первой реакции образуется метатитанат, а во второй -–ортоцирконат соответствующих металлов.
373.На гидроксиды цинка и кадмия подействовали избытком растворов серной кислоты, едкого натра и аммиака. Какие соединения цинка и кадмия образуются в каждом из этих случаев? Составьте молекулярные и ионные уравнения соответствующих реакций.
374. Золото растворяется в царской водке и в селеновой кислоте, приобретая при этом максимальную степень окисления. Составьте молекулярные и ионные уравнения соответствующих реакций.
375. В присутствии влаги и диоксида углерода медь окисляется и покрывается зеленым налетом. Как называется и каков состав образующегося соединения? Что произойдет, если на него подействовать соляной кислотой? Напишите уравнения соответствующих реакций. Окислительно-восстановительную реакцию составьте на основании электронных уравнений.
376. Кусок латуни обработали азотной кислотой. К раствору прибавили избыток раствора щелочи и нагрели. Какие соединения цинка и меди образуются при этом? Составьте уравнения соответствующих реакций.
377.Ванадий получают алюмотермически или кальцийтермически восстановлением ванадиевого ангидрида V2O5. Последний легко растворяется в щелочах с образованием метаванадатов. Напишите уравнения соответствующих реакций. Уравнения окислительно-восстановительных реакций составьте на основании электронных уравнений.
378.Азотная кислота окисляет ванадий до метаванадиевой кислоты. Составьте электронные и молекулярные уравнения соответствующих реакций.
379. Какую степень окисления проявляет ванадий в соединениях? Составьте формулы оксидов ванадия, отвечающих этим степеням окисления. Как меняются кислотно-основные свойства оксидов ванадия при переходе от низшей к высшей степени окисления. Составьте уравнения реакций: а) V2O3 c H2SO4; б) V2O5 c NaOH.
380. При внесении цинка в подкисленный серной кислотой раствор метаванадата аммония NH4VO3 желтая окраска постепенно переходит в фиолетовую за счет образования сульфата ванадия (+2). Составьте электронные и молекулярное уравнения реакции.
381. Хромит калия окисляется бромом в щелочной среде. Зеленая окраска раствора переходит в желтую. Составьте электронные и молекулярное уравнения реакции. Какие ионы обусловливают начальную и конечную окраску раствора?
382. Составьте электронные и молекулярные уравнения реакций: а) растворения молибдена в азотной кислоте; б) растворения вольфрама в щелочи в присутствии кислорода. Учтите, что молибден и вольфрам приобретают высшую степень окисления.
383. При сплавлении хромита железа Fе(СrО2)2 с карбонатом натрия в присутствии кислорода хром (+3) и железо (+2) окисляются и приобретают соответственно степень окисления +6 и +3. Составьте электронные и молекулярное уравнения реакции.
384. К подкисленному серной кислотой раствору дихромата калия прибавили порошок алюминия. Через некоторое время оранжевая окраска раствора стала зеленой. Составьте электронные и молекулярное уравнения происходящей реакции.
385. Хром получают алюмотермически из его оксида (+3), а вольфрам восстановлением вольфрамового ангидрида водородом. Составьте электронные и молекулярные уравнения соответствующих реакций.
386. Составьте уравнения реакций, которые надо провести для осуществления превращений:
Nа2Сr2О7 ® Nа2СrO4 ® Nа2Сr2O7 ® CrСl3.
Уравнение окислительно-восстановительной реакции напишите на основании электронных уравнений.
387. Марганец азотной кислотой окисляется минимально, а рений – максимально. Какие соединения при этом получаются? Составьте электронные и молекулярные уравнения соответствующих реакций.
388. Хлор окисляет манганат калия. Какое соединение при этом получается? Как меняется окраска раствора в результате этой реакции? Составьте электронные и молекулярное уравнения.
389. Как меняется степень окисления марганца при восстановлении КMnО4 в кислой, нейтральной и щелочной средах? Составьте электронные и молекулярное уравнения реакции между КMnО4 и КNО2 в нейтральной среде.
390. На основании электронных уравнений составьте уравнение реакции получения манганата калия сплавлением диоксида марганца с хлоратом калия в присутствии едкого кали. Хлорат восстанавливается максимально.
391. Почему диоксид марганца может проявлять и окислительные, и восстановительные свойства? Исходя из электронных уравнений составьте уравнения реакций:
а) МnО2 + КI + Н2SO4=? ; б) МnO2 + КNО3 + КОН = ?/
392. Для получения хлора в лаборатории смешивают диоксид марганца с хлоридом натрия в присутствии концентрированной серной кислоты. Составьте электронные и молекулярное уравнения этой реакции.
393. Составьте уравнения реакций, которые надо провести для осуществления следующихпревращений:
Fе ® FеSO4 ® Fе(ОН)2 ® Fе(ОН)3.
Уравнения окислительно-восстановительных реакций напишите на основании электронных уравнений.
394.Какую степень окисления проявляет железо в соединениях? Как можно обнаружить ионы Fe2+ и Fе3+ в растворе? Составьте молекулярные и ионные уравнения реакций.
395. Чем отличается взаимодействие тригидроксидов кобальта и никеля с кислотами от взаимодействия тригидроксида железа с кислотами? Составьте электронные и молекулярные уравнения соответствующих реакций.
396. Могут ли в растворе существовать совместно следующие вещества: а) FеСl3 и SnСl2; б) FеSO4 и NаОН; в) FеСl3 и К3[Fе(СN)6]? Составьте уравнения реакций.
397. Составьте уравнения реакций, которые надо провести для осуществления превращений: Ni ® Ni(NO3)2 ® Ni(OH)2 ® Ni(ОН)3. Уравнения окислительно-восстановительных реакций напишите на основании электронных уравнений.
398. Составьте электронные и молекулярныеуравнения реакций: а) растворения платины в царской водке; б) взаимодействия осмия с фтором. Платинаокисляетсядо степени окисления +4, а осмий – до +8.
399. Составьте молекулярные и ионные уравнения реакций, которые надо провести для осуществления следующих превращений
Fe ® FeCl2 ® Fe(CN)2 ® K4[Fe(CN)6].
400. Феррат калия К2FеО4 образуется при сплавлении Fе2О3 с калийной селитрой КNO3 в присутствии КОН. Составьте электронные и молекулярное уравнения реакции.
| Растворимость солей и оснований в воде Таблица 5 (приложение) (P-растворимое вещество, М-малорастворимое вещество, Н-практическаи нерастворимое вещество, черта означает, что вещество не существует или разлагается водой) | Катионы | Fe2+ | P | P | P | P | P | H | - | P | H | H | - | H | H |
| Fe3+ | P | P | - | P | - | H | - | P | - | H | - | H | H | ||
| Mn2+ | P | P | H | - | P | H | H | P | H | H | H | H | H | ||
| Cr2+ | P | P | P | P | - | - | - | P | - | - | P | H | H | ||
| Bl2+ | - | - | - | P | - | H | H | - | H | - | H | H | H | ||
| Pb2+ | M | M | H | P | P | H | H | H | H | H | H | H | H | ||
| Sn2+ | P | P | P | - | - | H | - | P | - | - | - | H | H | ||
| Al3+ | P | P | P | P | P | - | - | P | - | H | - | H | H | ||
| Hg2+ | P | M | H | P | P | H | H | - | - | - | H | H | - | ||
| Zn2+ | P | P | P | P | P | H | H | P | H | H | H | H | H | ||
| Ba2+ | P | P | P | P | P | P | H | H | H | H | H | H | P | ||
| Sr2+ | P | P | P | P | P | P | H | H | H | H | M | H | M | ||
| Ca2+ | P | P | P | P | P | P | H | M | H | H | M | H | M | ||
| Mg2+ | P | P | P | P | P | - | H | P | H | H | P | H | H | ||
| Ag+ | H | H | H | P | P | H | H | M | H | - | H | H | - | ||
| Cu2+ | P | P | - | P | P | H | H | P | - | - | H | H | H | ||
| NH4+ | P | P | P | P | P | P | P | P | P | - | P | P | P | ||
| Na+ K+ | P | P | P | P | P | P | P | P | P | P | P | P | P | ||
| Li+ | P | P | P | P | P | P | P | P | P | P | P | H | P | ||
| Анионы | Cl- | Br- | I- | NO-3 | CH3COO- | S2- | SO32- | SO42- | CO32- | SiO32- | CrO42- | PO43- | OH- |
| Периодическая система | |||||||
| Пери-оды | Ряды | Г р у п п ы элементов | |||||
| I | II | III | IV | V | |||
| I | H 1 1,00794 водород | ||||||
| II | Li 3 6,941 литий | Be 4 9,01218 бериллий | 5 B 10,81 бор | 6 C 12,011 углерод | 7 N 14,0067 азот | ||
| III | Na 11 22,98977 натрий | Mg 12 24,305 магний | 13 Al 26,98154 алюминий | 14 Si 28,0855 кремний | 15 P 30,97376 фосфор | ||
| IV | K 19 39,0983 калий | Ca 20 40,08 кальций | Sc 21 44,9559 скандий | Ti 22 47,90 титан | V 23 50,9415 ванадий | ||
| V | 29 Сu 63,546 медь | 30 Zn 65,38 цинк | 31 Ga 69,72 галлий | 32 Ge 72,59 германий | 33 As 74,9216 мышьяк | ||
| VI | Rb 37 85,467 рубидий | Sr 38 87,62 стронций | Y 39 88,9059 иттрий | Zr 40 91,22 цирконий | Nb 41 92,9064 ниобий | ||
| VII | 47 Ag 107,8682 серебро | 48 Cd 112,41 кадмий | 49 In 114,82 индий | 50 Sn 118,69 олово | 51 Sb 121,75 сурьма | ||
| VIII | Cs 55 132,9054 цезий | Ba 56 137,33 барий | La57-Lu71 * | Hf 72 178,49 гафний | Ta 73 180,9479 тантал | ||
| IX | 79 Au 196,9665 золото | 80 Hg 200,59 ртуть | 81 Tl 204,37 таллий | 82 Pb 207,2 свинец | 83 Bi 208,9804 висмут | ||
| X | Fr 87 [223] франций | Ra 88 226,0254 радий | Ac89-Lr103 * * | Ku 104 [261] курчатовий | Ns 105 [261] нильсбо-рий |
*Лантаноиды
| La 57 138,9055 лантан | Ce 58 140,12 церий | Pr 59 140,9077 празеодим | Nd 60 144,24 неодим | Pm 61 [145] проме-тий | Sm 62 150,4 самарий | Eu 63 151,96 европий | Gd 64 157,25 гадолиний |
Актиноиды
| Ac 89 [227] актиний | Th 90 232,0381 торий | Pa 91 231,0359 протак-тиний | U 92 238,029 уран | Np 93 237,0482 непту-ний | Pu 94 [244] плутоний | Am 95 [243] америций | Cm 96 [247] кюрий |
ПРИЛОЖЕНИЕ
| элементов Д.И.Менделеева | |||||||||||
| э л е м е н т о в | |||||||||||
| VI | VII | VIII | |||||||||
| (Н) | 2 Нe 4,00260 гелий | ||||||||||
| 8 O 15,9994 кислород | 9 F 18,9984 фтор | 10 Ne 20,179 неон | |||||||||
| 16 S 32,06 сера | 17 Cl 35,453 хлор | 18 Ar 39,948 аргон | |||||||||
| Cr 24 51,996 хром | Mn 25 54,9380 марганец | Fe 26 55,847 железо | Co 27 58,9332 кобальт | Ni 28 58,70 никель | |||||||
| 34 Se 78,96 селен | 35 Br 79,904 бром | 36 Kr 83,80 криптон | |||||||||
| Mo 42 95,94 молибден | Tc 43 98,9062 технеций | Ru 44 101,07 рутений | Rh 45 102,905 родий | Pd 46 106,4 палладий | |||||||
| 52 Te 127,60 теллур | 53 I 126,9045 йод | 54 Xe 131,30 ксенон | |||||||||
| W 74 183,85 вольфрам | Re 75 186,207 рений | Os 76 190,2 осмий | Ir 77 192,22 иридий | Pt 78 195,09 платина | |||||||
| 84 Po [209] полоний | 85 At [210] астат | 86 Rn [222] радон | |||||||||
| Tb 65 158,9254 тербий | Dy 66 162,50 диспро-зий | Ho 67 164,930 гольмий | Er 68 167,26 эрбий | Tm 69 168,934 тулий | Yb 70 173,04 иттер-бий | Lu 71 174,967 лютеций | |||||
| Bk 97 [247] берклий | Cf 98 [251] калифорний | Es 99 [254] эйнштейний | Fm 100 [257] фермий | Md 101 [258] менделевий | No 102 [255] нобелий | Lr 103 [256] лоурен-сий |
Таблица растворимости соединений
| Ионы | Br-- | CH3COO | CN- | CO32- | Cl- | CrO42- | F- | I- | NO3- | OH- | PO43- | S2- | SO42- | SiO32- или SiO44- |
| Ag+ | н | м | н | н | н | н | р | н | р | - | н | н | м | - |
| Al3+ | р | + | - | - | р | - | м | р | р | н | н | + | р | н |
| Ba2+ | р | р | р | н | р | н | м | р | р | р | н | р | н | н |
| Be2+ | р | + | - | + | р | - | р | р | р | н | н | + | р | н |
| Bi3+ | + | + | - | - | + | н | н | н | + | н | н | н | + | н |
| Ca2+ | р | р | р | н | р | м | н | р | р | м | н | р | м | н |
| Cd2+ | р | р | м | + | р | - | р | р | р | н | н | н | р | н |
| Co2+ | р | р | н | - | р | - | р | р | р | н | н | н | р | н |
| Cr3+ | р | + | н | - | р | - | м | н | р | н | н | + | р | - |
| Cs+ | р | р | р | р | р | р | р | р | р | р | р | р | р | р |
| Cu2+ | р | р | н | - | р | н | p | - | р | н | н | н | р | - |
| Fe2+ | р | р | н | н | р | - | м | р | р | н | н | н | р | н |
| Fe3+ | р | - | н | - | р | - | н | - | р | н | н | + | р | н |
| Ga3+ | + | - | - | - | р | - | н | + | р | н | н | + | р | - |
| H+ | р | р | р | м | р | р | р | р | р | р | р | м | р | н |
| Hg2+ | м | р | р | - | р | н | + | н | р | - | н | н | + | - |
| Нg22+ | н | м | - | н | н | - | м | н | + | - | н | - | н | - |
| In3+ | р | - | н | - | р | - | м | р | р | н | н | н | р | - |
| K+ | р | р | р | р | р | р | р | p | р | р | р | р | р | р |
| La3+ | р | р | - | + | р | - | н | р | р | н | н | н | м | - |
| Li+ | р | р | р | р | р | р | н | р | р | р | м | р | р | р |
| Mg2+ | р | р | р | м | р | р | м | р | р | н | н | н | р | н |
| Mn2+ | р | p | н | + | р | н | р | р | р | н | н | н | р | н |
| NH4+ | р | p | р | р | р | р | р | р | р | р | р | + | р | - |
| Na+ | р | р | р | р | р | р | р | р | р | р | р | р | р | р |
| Ni2+ | р | р | н | + | р | - | р | р | р | н | н | н | р | - |
| Pb2+ | м | р | н | + | м | н | м | м | р | н | н | н | н | н |
| Pt2+ | н | - | н | - | н | - | - | н | - | н | - | н | - | - |
| Rb+ | р | р | р | р | р | р | р | р | р | р | р | р | р | р |
| Sc3+ | р | р | - | + | р | - | н | р | р | н | н | н | р | н |
| Sn2+ | + | + | - | - | + | - | р | м | + | н | н | н | + | - |
| Sr2+ | р | р | р | н | р | м | н | р | р | м | н | р | н | н |
| Tl+ | м | р | р | р | м | н | р | н | р | р | н | н | м | - |
| Y3+ | р | р | - | + | р | - | м | р | р | н | н | н | р | - |
| Zn2+ | р | р | н | + | р | н | м | р | р | н | н | н | р | н |
Обозначения: р – растворимый, м – малорастворимый, н – нерастворимый,
(+) – подвергается гидролизу, (–) – не существует
СОДЕРЖАНИЕ
| Стр. | |
| Общие методические указания………………………………………. | |
| Программа…………………………………………………………….. | |
| Литература…………………………………………………………….. | |
| Таблица вариантов контрольных заданий…………………………... | |
| Контрольные задания………………………………………………… | |
| Контрольное задание 1……………………………………………….. | |
| Строение атомов………………………………………………….. | |
| Периодическая система элементов Д.И.Менделеева…………... | |
| Химическая связь и строение молекул. Конденсированное со-стояние вещества…………………………………………………. | |
| Энергетика химических процессов (термохимические расчеты)………………………………………………………………….. | |
| Направление самопроизвольных процессов……………………. | |
| Химическая кинетика и равновесие……………………………. | |
| Способы выражения концентрации раствора…………………. | |
| Свойство растворов……………………………………………... | |
| Ионные реакции обмена………………………………………… | |
| Гидролиз солей………………………………………………….. | |
| Контрольное задание 2……………………………………………….. | |
| Окислительно-восстановительные реакции………..…………… | |
| Электродные потенциалы и электродвижущие силы………….. | |
| Электролиз………………………………………………………... | |
| Коррозия металлов……………………………………………….. | |
| s-элементы (…ns1-2)……………………………….……………... | |
| Жесткость воды и методы ее устранения………………………. | |
| p-элементы (…ns2np1-6)………………………………………….. | |
| d-элементы (…(n-1)d1-10ns0-2)……………………………………. | |
| Приложения…………………………………………………………… |
Лицензия ЛР № 020370от 29.01.97
Составители: Т.К.Томчук, С.А.Колесова, Л.Г.Черанева, М.М.Соколова, Н.Б.Ходяшев, Т.С.Соколова, Т.Г.Мальцева, И.С.Глушанкова, Г.А.Старкова, Н.М.Чебыкина, И.С.Колесов, Т.А.Махнева
Компьютерная верстка Макаров Д.В.
Подписано в печать
Формат 60 х 84/16. Печать офсетная.
Набор компьютерный. Усл. печ. л. 4,75.Уч.-изд. Л. 5,25. Тираж . Заказ
Редакционно-издательский отдел и ротапринт– Конец работы –
Используемые теги: Химия0.044
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: ХИМИЯ
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов