рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Химическая связь. Типы взаимодействия молекул
Реферат Курсовая Конспект
Химическая связь. Типы взаимодействия молекул
Химическая связь. Типы взаимодействия молекул - раздел Химия, Химическая Связь. Типы Взаимодейс...
Химическая связь. Типы взаимодействия молекул
Ни одно из известных взаимодействий – электрическое, магнитное или гравитационное – в применении к микрообъектам не обладает свойством насыщаемости,… Квантовая механика дала решение вопроса о природе химической связи. Основные типы химической связи: ковалентная, ионная, водородная и металлическая. Нет единой теории описывающей все…Причина образования химической связи – понижение полной энергии системы.
Рис.1 Зависимость потенциальной энергии Е системы из двух атомов водорода от межъядерного расстояния r: 1 - при образовании химической связи; 2 –… На данном рисунке показана энергетическая кривая, характерная для… Процесс перехода электрона на более высокий энергетический подуровень или уровень (т.е. процесс возбуждения или…Ковалентная связь
Для молекулярных систем, как и для многоэлектронных атомов, невозможно точное решение уравнения Шрёдингера. Приближённые решения достигаются введением упрощающих предположений о том, что при образовании молекулы происходят лишь ограниченные изменения.
Существует два способа объяснения характера ковалентной связи- метод валентных связей (МВС) и метод молекулярных орбиталей (ММО).
Метод валентных связей
Основные положения МВС
2)Ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака. 3)При образовании молекулы электронная структура составляющих её атомов в… В целом электронная структура молекулы выглядит как набор различных валентных схем(метод локализованных пар).Механизмы образования химической связи
Обменный механизм. К обменному механизму образования химической связи относятся случаи, когда в образовании электронной пары от каждого атома… В молекулах Н2, Li2, Na2 связи образуются за счет неспаренных s-электронов… p-электронами галогенов. Особенностью образования соединений по обменному механизму является насыщаемость, которая…Донорно-акцепторный механизм
Примерами образования химической связи по донорно-акцепторному механизму являются: а) реакция аммиака с ионом водорода: H+ + ׃NH3 = NH4+Валентность
При образовании химической связи по обменному механизму каждый из взаимодействующих атомов по одному неспаренному электрону для образования… При определении числа химических связей, которые атом элемента может… Поэтому возбуждённые состояния атомов возникающие в результате таких переходов у элементов первых трёх периодов не…Гибридизация атомных орбиталей и геометрия молекул
Важной характеристикой молекулы, состоящей более чем из двух атомов, является ее геометрическая конфигурация. Она определяется взаимным расположением атомных орбиталей, участвующих в образовании химических связей.
Перекрывание электронных облаков возможно только при определенной взаимной ориентации электронных облаков; при этом область перекрывания располагается в определенном направлении по отношению к взаимодействующим атомам.
Таблица 1 Гибридизация орбиталей и пространственная конфигурация молекул
| Тип молекулы | Исходные орбитали атома А | Тип гибридизации | Число гибридных орбиталей атома А | Пространственная конфигурация молекулы |
| АВ2 | s + p | sp | линейная | |
| АВ3 | s + p + p | sp2 | треугольная | |
| АВ4 | s + p + p + p | sp3 | тетраэдрическая |
Возбужденный атом бериллия имеет конфигурацию 2s12p1, возбужденный атом бора - 2s12p2 и возбужденный атом углерода - 2s12p3. Поэтому можно считать, что в образовании химических связей могут участвовать не одинаковые, а различные атомные орбитали. Например, в таких соединениях как BeCl2, BeCl3,CCl4 должны быть неравноценные по прочности и направлению связи, причем σ-связи из p-орбиталей должны быть более прочными, чем связи из s-орбиталей, т.к. для p-орбиталей имеются более благоприятные условия для перекрывания. Однако опыт показывает, что в молекулах, содержащих центральные атомы с различными валентными орбиталями (s, p, d), все связи равноценны. Объяснение этому дали Слейтер и Полинг. Они пришли к выводу, что различные орбитали, не сильно отличающиеся по энергиям, образуют соответствующее число гибридных орбиталей. Гибридные (смешанные) орбитали образуются из различных атомных орбиталей. Число гибридных орбиталей равно числу атомных орбиталей, участвующих в гибридизации. Гибридные орбитали одинаковы по форме электронного облака и по энергии. По сравнению с атомными орбиталями они более вытянуты в направлении образования химических связей и поэтому обусловливают лучшее перекрывание электронных облаков.
Гибридизация атомных орбиталей требует затрат энергии, поэтому гибридные орбитали в изолированном атоме неустойчивы и стремятся превратиться в чистые АО. При образовании химических связей гибридные орбитали стабилизируются. Вследствие более прочных связей, образованных гибридными орбиталями, из системы выделяется больше энергии, и поэтому система становится более стабильной.
Sp- гибридизация
Рис.3 sp-гибридные орбитали Экспериментальные данные показывают, что все галогениды Be, Zn, Cd и Hg (II) линейны и обе связи имеют одинаковую…Sp2-гибридизация
В результате гибридизации одной s-орбитали и двух p-орбиталей образуются три гибридные sp2-орбитали, расположенные в одной плоскости под углом 120о друг к другу. Такова, например, конфигурация молекулы BF3 :
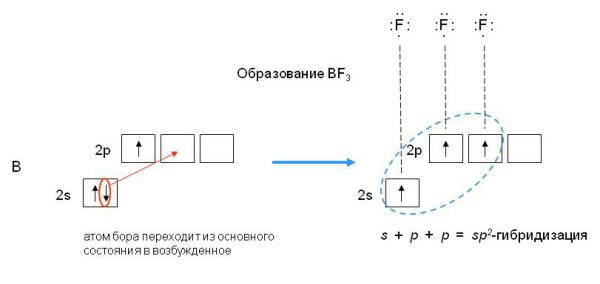
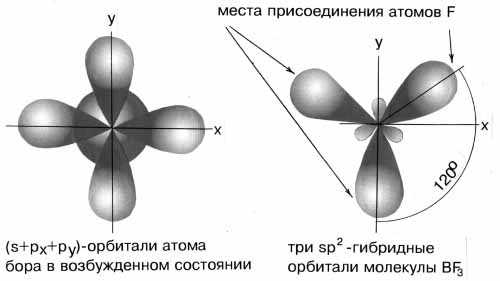
Рис.4sp2-гибридизация
Sp3-гибридизация
р-орбиталей образуются четыре гибридные sp3-орбитали, направленные к вершинам тетраэдра с углом между орбиталями 109,5о. Гибридизация проявляется в…Метод молекулярных орбиталей
Установлено, что в ряде случаев определяющую роль в образовании химической связи играют не электронные пары, а отдельные электроны. На возможность… 255 кДж (61 ккал). Таким образом, химическая связь в ионе H2+ довольно… Если попробовать описать химическую связь в молекуле кислорода по методу ВС, то придем к заключению, что, во-первых,…Полярность связи
Если соединяющиеся атомы обладают различной ЭО, то электронное облако, находящееся между ними, смещается из симметричного положения ближе к атому с… Смещение электронного облака называется поляризацией. В результате… На атоме водорода возникает положительный заряд δ= +0,18, а атоме хлора - отрицательный δ=-018.…Ионная связь
Ионные молекулы существуют только в парах над нагретыми солями. Энергия разрыва ионной связи не определяется энергией притяжения ионов.
Еионизации Cs = 3,86 эВ > Есродства к электрону Cl = 3,83 эВ
Таким образом, даже такая «предельно ионная» молекула CsCl фактически не является ионной на 100%. Силы притяжения имеют кулоновскую природу, а в силах отталкивания необходимо учитывать квантовую составляющую сил отталкивания, которая зависит от корреляции спинов. Е отт. = B/ rn (М. Борн) , где r- межионное расстояние
В- некоторая константа, п –показатель степени(≈ 9).
Потенциальная энергия для однозарядных ионов:
Е = Епр. + Еотт. = − e2/ r + B/rn ( e – заряд электрона).
Нужно отметить, что в парах ионных соединений содержатся не только молекулы, а также простые и сложные ионы. Например, в парах NaCl имеются следующие частицы: NaCl, (NaCl)2, (NaCl)3, (Na2Cl)+, (NaCl2)- .
Отклонения от чисто ионной связи можно рассматривать как результат электростатического воздействия ионов друг на друга, считая их деформируемыми системами, при этом не учитывающих изменение кинетической энергии электронов и их волновые свойства.
В первом приближении индуцированный дипольный момент можно считать пропорцианальным напря жённости электрического поля Е: µинд.= αЕ, где α- поляризуемость частицы(измеряется в Кл ∙м2/В).
Таблица 4 Поляризуемость α ( Кл∙м2/В) и кубы радиусов r3(м3) некоторых ионов.
| Ион | α∙ 1040 | r3∙1030 | Ион | α∙ 1040 | r3∙1030 | Ион | α∙1040 | r3∙1030 | Ион | α∙1040 | r3∙1030 |
| Li+ | 0,026 | 0,32 | Be2+ | 0,007 | 0,043 | F- | 0,86 | 2,35 | O2- | 2,47 | 2,3 |
| Na+ | 0,168 | 0,92 | Mg2+ | 0,093 | 0,29 | Cl- | 3,21 | 5,92 | S2- | 8,05 | 5,3 |
| K+ | 0,799 | 2,35 | Ca2+ | 0,497 | 0,97 | Br- | 4,49 | 7,50 | Se2- | 10,3 | 7,0 |
| Rb+ | 1,340 | 3,18 | Sr2+ | 0,92 | 1,40 | I- | 6,81 | 10,60 | Te2- | 14,5 | 9,4 |
| Cs+ | 2,310 | 4,67 | Ba2+ | 1,67 | 2,40 |
В электрическом поле ион или молекула деформируются, т.е. в них происходит относительное смещение ядер и электронов. Такая деформируемость ионов и молекул называется поляризуемостью. Поскольку наименее прочно в атоме связаны электроны внешнего слоя, то они испытывают смещение в первую очередь.
В первом приближении поляризация иона обусловлена только деформацией внешней электронной оболочки. При одинаковых зарядах и близких радиусах поляризация минимальна у ионов с конфигурацией благородного газа и максимальна – у ионов с 18 внешними электронами. Промежуточное значение поляризации – у ионов переходных металлов с незавершённой d-оболочкой. Значительная поляризуемость ионов d-элементов объясняется большим числом внешних электронов у них. Поляризуемость ионов элементов в каждой подгруппе растёт с увеличением порядкового номера. Для элемента с разными зарядами поляризуемость тем меньше, чем больше его заряд. В ряду изоэлектронных ионов с конфигурацией атомов благородных газов поляризуемость растёт с уменьшением положительного заряда: Mg2+ < Na+ < Neo < F- < O2-
Поляризующее действие ионов тем больше, чем меньше радиус и чем устойчивее электронная оболочка иона.
Наибольшее поляризующее действие оказывают те ионы, которые слабо поляризуются.
Если катион легко деформируется, то возникший в нём диполь усиливает его поляризующее действие на анион; анион, в свою очередь, оказывает дополнительное воздействие на катион – возникает дополнительный поляризационный эффект. Дополнительный поляризационный эффект и тем самым суммарное поляризующее действие особенно велики для 18- электронных катионов(Zn2+,Cd2+,Hg 2+ и др.). Увеличение стягивания ионов в результате их поляризации приводит к тому, что длина диполя оказывается меньше межъядерного расстояния. Например, в молекуле KCl длина диполя составляет 167пм, а межъядерное расстояние – 267пм. Особенно велики различия у водородсодержащих соединений. Расстояние между ядрами водорода и галогена меньше радиуса иона галогена. Так, r(Cl-)= 181пм, в то время как расстояние между ядрами элементов равно127пм. В отличие от других катионов проникает внутрь электронной оболочки аниона. Проникновение протона внутрь аниона приводит к уменьшению длины диполя и деформируемости аниона.
С увеличением деформируемости аниона может произойти полный переход электронов от него к катиону, т.е. образуется ковалентная связь. Наоборот, чем меньше поляризация иона, тем ближе соединение к ионному типу.
Хлорид серебра растворяется в воде хуже хлорида натрия.Радиус Ag+ соизмерим с радиусом Na+, но поляризуемость больше и поэтому в AgCl межъядерное расстояние меньше, а энергия разрыва связи на ионы больше, чем в хлориде натрия.
Повышение температуры обычно способствует поляризации.Чем сильнее поляризация тем ниже температура диссоциации. Разложение CaI2 требует высоких температур, а CuI2 – низких температур, поэтому в обычных условиях CuI2 не существует.
Кислоты Н2СО3 и H2SO3 менее стабильны, чем их соли. Причины: а) очень сильное поляризующее действие Н+ ;б) протон, внедряясь в кислородный анион, снижает его заряд и уменьшает деформируемость; поэтому HCO3- и HSO3- менее устойчивы, чем CO32- и SO32- ;в) второй протон делает частицу ещё менее устойчивой, поэтому H2CO3 и H2SO3легко теряют воду.
Это также является одной из причин, почему кислородсодержащие кислоты – более сильные окислители, чем их соли.
Деформируемость электронной оболочки влияет и на оптические свойства соединений Поглощение лучей связано с возбуждением внешних электронов. Электронные переходы отвечают тем меньшим энергиям чем более поляризуема частица. Если частица малополяризуема, то возбуждение требует больших энергий, им отвечаеют ультрафиолетовые лучи. Если частица легко поляризуется, то возбуждение требует квантов небольшой энергии, им отвечает видимая часть спектра. В этом случае вещество окрашено. Так PbI2 имеет жёлтую окраску а CaI2 –бесцветен. Среди сульфидов металлов встречается гораздо больше окрашенных соединений чем среди оксидов.В ряду PbCl2 - PbBr2- PbI2 окраска соли углубляется.
При образовании ионной связи электрическое поле иона обладает сферической симметрией и поэтому ионная связь не обладает направленностью и насыщаемостью.
Водородная связь
Молекулы фторида водорода HF в твёрдом жидком и даже в газовом состоянии ассоциированы в зигзаобразные цепочки (рис.23 ).Рис.25 Образование внутримолекулярной водородной связи
Энергия связи
Энергия связи – это энергия, которая выделяется при образовании молекулы из атомов. Энергию связи обычно выражают в кДж/моль (или ккал/моль). Это…Для двухатомных молекул энергия связи равна энергии диссоциации. Для многоатомных молекул с одним типом связи средняя энергия связи равна 1/n части распада молекулы на атомы. Энергия распада метана на атомы равна
КДж/моль. В молекуле метана имеются четыре равноценные связи С-Н поэтому средняя энергия такой связи равна
Ес-н = 1649/4 = 412 кДж/моль. При последовательном отрыве атомов водорода меняется ядерная и электронная конфигурация системы и следовательно изменение энергии взаимодействия атомов, входящих в молекулу. Так, последовательный отрыв водорода от метана связан с затратой энергии равной соответственно 427, 368, 519 и
КДж/моль. Однако для любого вещества среднее арифметическое значение энергии отрыва совпадает со средней энергией связи. Ес-н = (427 + 368 + 519 +335)/4 = 412 кДж/моль.
Таблица 5 Длина и энергия разрыва связей
| d пм | E кДж/моль | d пм | E кДж/моль | ||
| C-H | C=O | ||||
| C-F | O-H | ||||
| C-Cl | O-O | ||||
| C-Br | S-H | ||||
| C-I | N-H | ||||
| C-C | As-H | ||||
| C=C | |||||
| C≡C |
При переходе от одинарной связи двойной и тройной (между одними и теми же атомами) энергия связи возрастает, однако связь укрепляется непропорцианально увеличению её кратности.
Таблица 5 показывает:а)закономерное изменение энергии для однотипных связей(C-F>C-Cl>C-Br>C-I),
Б)что длина связи уменьшается с возрастанием порядка или кратности связи, а
Прочность увеличивается с уменьшением длины связи.
Химическая связь в твердых телах. Свойства твердых веществ определяются природой частиц, занимающих узлы кристаллической решетки и типом… Твердые аргон и метан образуют атомные и молекулярные кристаллы… Температуры плавления ионных кристаллов выше, чем атомных и молекулярных, поскольку электростатические силы,…– Конец работы –
Используемые теги: Химическая, связь, типы, взаимодействия, молекул0.083
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Химическая связь. Типы взаимодействия молекул
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов